2型糖尿病的血管功能障碍的分子机制和心血管标志物
2型糖尿病患者的心血管疾病负荷
代谢性疾病的流行病学
久坐的生活方式,高脂质摄入的饮食习惯以及遗传的倾向性使得肥胖和T2DM的发病率在全球范围内迅速增长(1,2)。目前,超重者占全球总人数的1/3;约1/5是明显的肥胖,并且其在此后的几年将极有可能患有糖尿病。国际糖尿病联会估计目前全球有382万的糖尿病患者,其中在成年人群中校整年龄后其患病率在6%-37.5%之间(3)。引人注意的是,根据目前的数据推测到2030年,欧洲的T2DM发病率将增加32%,美国增加72%,发展中国家则达160%的升高,届时糖尿病患者数量将达到439万(占全球总人数的7%)(4)。与这些大量的流行病学数据相比,基因学和表观遗传学分析显示肥胖和T2DM患者发生的基因激活事件会传递给后代(6,1)。而这些基因修饰的遗传性可能预示疾病的表观已经存在于年轻正常体重的个体中。因此,代谢特征向下一代传递将增加肥胖相关紊乱的指数,从而进一步提高患者的患病率和死亡率(7)。
T2DM患者的心血管疾病预防
流行病学的调查研究显示T2DM与心血管事件发生风险之间存在着显著的相关性(8)。T2DM与微血管及大血管并发症增多相关,并且能够将患者死亡率增加至接近正常人2倍(9)。虽然在治疗方面的进步使得T2DM患病率及死亡率明显下降,但是其心血管风险还没有根除。最近的一些临床随机试验研究显示严格控制心血管风险因素不能全面有效地减少T2DM患者的心血管终点事件(10),而且这种获益不能够长期持续。在ADVANCE试验中严格控制血糖可使肾病患病率降低21%,其中肾病主要检测微量蛋白尿(11)。然而,使血糖恢复到正常水平并没有减少视网膜病的发病率,更重要的是没有减少大血管并发症。同样,联合应用培哚普利和吲达帕胺严格控制血压可减少肾脏并发症,但对其他微血管及大血管并发症无影响(11)。控制糖尿病患者心血管风险行动(Action to Control Cardiovascular Risk in Diabetes,ACCORD)的研究有助于提高我们对严格控制治疗方案获益性的困惑和怀疑(12)。由于严格控制血糖组患者出现大量心血管事件从而导致这一临床随机试验被迫提前结束。与这些目前的试验结果不同,来自STENO-2试验的早期证据提示利用降糖、降压及他汀类药物进行多因素严格的干预是获益的(13)。然而,长期随访发现微血管并发症的剩余风险远远超过这种治疗的获益(10,14)。一项长达7.8年的治疗周期的调查研究显示,接受严格治疗的T2DM患者中并发或表现出糖尿病视网膜病所占比例为51%,肾病为25%,周围神经病变为55% (10)。调查者惊讶地发现即便选择最优的方案进行血压控制和糖化血红蛋白控制,在延长随访时期内严格控制组与传统治疗组相比仍然出现新发的微血管并发症(14)。尽管服用他汀类药物将致动脉粥样硬化的低密度脂蛋白(low density lipoprotein,LDL)长期降低,T2DM患者剩余的血管风险仍然在持续增加(15)。在T2DM患者中血清高甘油三脂和低高密度脂蛋白(high density lipoprotein,HDL)是心血管风险的重要决定因素。正如FIELD (16)及最近的ACCORD (17)和AIM-HIGH(18)等试验结果表明利用药理学的方法改变其他脂质组成成分均不能减少心血管事件的预后。综上所述,这些结果提示即使严格控制危险因素聚集,也不能阻止糖尿病患者心血管并发症的发生发展。基于以上观点,阐明糖尿病内环境新型的分子网络将有助于新的诊断手段和治疗方案建立。
糖尿病患者血管功能紊乱的机制
在过去的20年里,基础和临床研究已经阐明了在T2DM患者体内高血糖和受损的胰岛素信号通路与血管疾病之间存在着强烈的生物相关性(19)。这些研究尽管提供了重要的发病机制线索,但目前仍难以证实高血糖症和胰岛素抵抗对糖尿病患者内皮或者血管壁的损伤具体机制(2)。T2DM的特征在这种疾病同时伴随多种情况,包括较轻的炎症反应、胰岛素通路受损及高血糖症等(20,21)。这就使得在描述T2DM血管功能失调始动因素时不能简单地像T1DM利用血糖水平来衡量。
糖尿病内皮细胞中的氧化还原敏感途径
目前一些机制研究数据显示T2DM的内皮细胞中存在一些有害的生物化学通路激活,进而促进线粒体的破坏和凋亡(22,23)。关于糖尿病性血管并发症的较完善的理论指出活性氧(reactive oxygen species,ROS)是触发血管功能失调的复杂分子网络的上游调节因子(24)。一些实验的确已经证实在糖尿病患者中高血糖症能够引起线粒体中ROS的聚集以及随后的糖基化终产物(advanced glycation end products,AGEs)、蛋白激酶C(protein kinase C,PKC)及核因子-kB(nuclear factor-kB,NF-κB)等活化和氨基已糖流出(25)(图1)。高血糖的环境可诱导血管内皮细胞中二脂酰甘油水平慢性增高,从而导致细胞膜中经典(α, β1, β2)和非经典(δ)PKC同工体的移位。我们实验组及其他研究人员均已证实PKCβ2在糖尿病内皮细胞中高度被激活,并伴随着氧化应激、胰岛素通路受损,尤其是内皮功能失调(利用血流介导的血管舒张试验进行评估)(23,26)。PKCβ2一旦被激活可以通过线粒体适配器p66Shc和NADPH氧化酶亚基p47(phox)(自由基的两种酶学来源)使其信号通路保持持续恶性活化状态(19)(图1)。高糖活化的PKCβ2促进适配器36位点上的丝氨酸发生磷酸化形成p66Shc,从而诱发线粒体细胞色素C氧化反应并导致细胞器内活性氧的聚集(27,28)。此外,高糖诱导的PKC活化作用可通过NADPH氧化途径产生超级氧化产物。而这种机制已经在人类内皮细胞模型中被证实:即应用PKCβ抑制剂能够阻断NADPH依赖的活化氧的产生(29)。本课题组前期实验提示高糖环境下PKCβ同样也是NF-κB信号通路的重要调节因子。PKCβ2的活化使得核因子κB(inhibitory subunit of nuclear factor-kappa B,IkBα)抑制亚基表达水平降低,促进NF-κB介导的血管细胞粘附因子-1转录表达(30)。研究发现选择性PKCβ2抑制剂可明显阻断细胞中IkBα降解,从而减轻高糖诱导内皮细胞的炎症反应。综上所述,现阶段的研究提示PKC是高血糖损害和胰岛素信号通路的受损上游调节因子(27)。
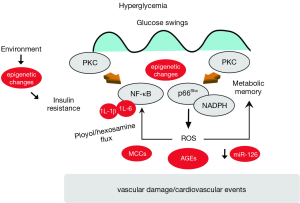
T2DM中的线粒体适配器p66Shc:是否可以阻断?
适配器p66Shc是一种氧化还原,参与线粒体中ROS的产生和氧化信号通路向凋亡的转化过程(31,33)。我们已经证实敲除小鼠p66Shc基因可明显阻断高血糖症诱导血管内皮细胞发生功能失调(33)。临床试验同样证实p66Shc与糖尿病之间存在相关性: T2DM患者外周血单核细胞中p66Shc基因表达增加,并伴随着血清中异前列烷水平升高(异前列烷是体内氧化应激作用的可靠标志物)(34)。近期我们的研究发现即使严格控制糖尿病小鼠血糖水平,已经被活化上调的p66Shc不仅不能恢复正常反而通过复杂的恶性循环方式(包括:ROS、表观改变及PKC活化)导致持续的氧化损伤和血管功能失调(26)(图1)。有趣的是,在利用胰岛素将血糖控制在正常范围时沉默体内p66Shc基因能够减轻内皮功能失调程度,提示在“代谢记忆”现象中p66Shc是重要的氧自由基来源(35,36)(图1)。因此,我们的研究成果提示抑制糖尿病患者p66Shc基因可能有助于患者正在进展的血管内皮损伤。这些机制性的思考能帮助人们理解为什么血糖控制不能改善糖尿病患者的心血管事件。
血糖波动:不良内皮细胞信号通路的驱动者
T2DM患者血管损伤的一个重要决定因素是血糖的波动(37)。实验数据表明是间歇性的高血糖维持ROS产生器活化(如:PKC和NADPH氧化反应),而不是持续性的高血糖(29)(图1)。同样,暂时的高血糖可引起表观改变,从而导致核转录因子NF-κB p65的持续上调以及随后的炎症性黏附分子表达增加(38)。转录因子在内皮细胞功能失调、胰岛素抵抗和血管过早老化等方面具有重要联系作用,因此发现研究调节NF-κB信号通路关键分子可能为治疗提供重要启示(39)。众所周知,T2DM患者血糖值总是在峰值与峰谷之间波动(40),这种变异性是否能激活炎症性通路是值得研究的。Monnier等的研究显示在T2DM患者体内与持续性的高血糖症相比餐后血糖波动或者血糖变化时能够更加明显地诱发氧化应激(41)。总体来讲,T2DM患者体内出现的持续性的血管损伤可能是体内血糖水平不断变化的结果,而在临床实践中这种波动很难利用标准的糖标记物进行检测。流行病调查显示HbA 1c能解释出现糖尿病并发症风险发生改变的因素,但这在总因素中所占比例不足25%(42,43)。
T2DM患者心血管风险的预测:寻找合适的生物标志物
我们对糖尿病并发症发生机制的认识可能有助于识别患者体内心血管损伤的潜在生物化学前体。由于每位肥胖或糖尿病患者所伴随的炎症反应和氧化应激程度不尽相同,因此有必要对患者进行风险分级。多样的代谢表型伴有不同的临床结局提示我们需要在不同人群中寻找一些新型的生物标志物。社区动脉粥样硬化危险(atheroscleroticrisk in communities ,ARIC)研究希望在中年男性和女性中观察在基础危险模型中增加C反应蛋白或其他18种新型危险因素是否能够提高冠状动脉事件的预测性(44),结果显示这些危险标志物对CVD的预测能力均不能超过现有的风险评估。考虑到这些结果令人不太满意,目前欧洲糖尿病指南提出在T2DM中蛋白尿仍然是最有力的心血管事件及心力衰竭预测因子,并且推荐利用尿白蛋白排泄率对糖尿病患者进行危险分级 (45)。此外,通常应用的血管风险评估并不是完善的,临床医师应该认识到评估的重要性,多变性及局限性(46)。
表观遗传学特点
尽管起初对基因标志物抱有很大的希望,但其预测和预防冠状动脉疾病的临床应用有局限性(47)。最近,心血管疾病专家提出表观遗传学可能将更好的满足目前在心血管疾病预防上遇到的需要(48)。表观遗传学是指DNA序列不变而活性改变时基因表达的可遗传改变(49)。表观遗传现象主要可以分为三类:(I)DNA甲基化;(II)依赖RNA的相关机制,包括微小RNAs(microRNA)和非编码RNAs;(III)转录后组蛋白修饰。目前大多数的研究主要集中在DNA甲基化和微小RNAs及它们与心血管疾病表型的联系。
DNA甲基化
关于心血管疾病表观生物标志物的研究最先针对的是总DNA甲基化。在哺乳动物中减少DNA甲基化可有利于基因的表达,这一机制已经得到广泛的认同(49)。在糖尿病环境中,启动子的低甲基化将引发涉及炎症、肥胖、β细胞功能失调和血管氧化损伤等基因表达上调(6)。荷兰的一项实验证实与无代谢综合征者相比代谢综合征患者具有较低的DNA甲基化(50)。而代谢综合征的两个组成成分(空腹血糖和高密度脂蛋白)与DNA甲基化程度之间存在线性相关。该研究还发现T2DM或糖耐量异常患者其DNA甲基化水平较血糖正常者低。从机制上来讲,我们最近报道p66Shc基因的低甲基化是实验性糖尿病代谢遗传的重要机制(26)。总体上讲,许多研究者都在探索DNA甲基化对心血管损伤和死亡率的影响。但是,目前关于其临床应用的热情很可能远超过可应用的证据。一般的观念是DNA甲基化的总体改变只能为不同的组织和器官中的生物学过程提供一个较为粗糙的评估。表观基因组的修正是否具有血管风险预测的可能性需要大规模的调查来证实,例如国际人类表观基因组联盟(International Human Epigenome Consortium),其目的是在10年内描绘出1000例参考表观基因组(51)。如此广泛的表观基因组分析向有助于识别表观基因的改变,尤其是在一些重要的病理状态下的变化,例如:T2DM和心血管事件。在T2DM患者体内表观基因组学结合其他高产量“组学“技术(如:代谢组学、转录组学和蛋白质组学)的预测价值正在谨慎地研究中,旨在获得大规模关于联系糖尿病和血管疾病的病因学过程的简要情况。关于利用后基因组作为诊断/预防方法的实际应用已经被广泛地报道而且已经超于目前文献报道的规模(52,53)。
微小RNAs
作为新近发现的小非编码RNAs,微小RNAs(MicroRNAs,miRs)在糖尿病患者并发血管损伤的发病机制中表现出重要的作用(54)。非编码RNAs通过在转录后水平调节基因的表达从而将复杂的分子网络进行协调地结合。基因芯片分析显示在T2DM患者中出现miRs表达改变(55)。研究结果还显示糖尿病患者表现出明显地miRs失调,而这些miRs涉及到血管生成、修复及内皮细胞稳态。在这些miRs中,miR-126(56)(重要的促血管生成物)在来自Brunick队列的822例患者血浆中表达明显下降(55)。同样,另一项关于176例患或不患糖尿病的稳定性冠心病患者循环颗粒中miR-126基因表达的研究显示糖尿病患者组miR-126表达明显减少(57)。
炎症性因子
炎症通路激活在高血糖症和胰岛素抵抗与内皮细胞功能失调的病因学通路中具有重要的作用。许多研究者提供了大量关于T2DM患者中炎症性细胞因子和化学因子的调节及其与血管损伤之间的关系重要的证据。在基于人口的前瞻性EPIC(欧洲前瞻性癌症与营养学研究)研究中一项病例对照试验结果显示IL-1β和IL-6的联合升高能够独立地引起T2DM患者风险增加。这提示低等级的炎症反应在糖尿病患者发病机制中占有重要作用。一项横断面分析表明与无T1DM者相比,IL-6和胶原蛋白原在T1DM患者体内表达水平明显增加,并与肥胖和血糖控制情况无关(58)。另一项研究显示IL-6在进行PCI术处于高血糖状态的糖尿病患者的体内表达明显上升,而且与氯吡格雷和阿司匹林服用情况成反比(59)。相比之下,其他系统性炎症反应的指标如C反应蛋白则不能预测糖尿病患者的心血管疾病事件(44)。
血管钙化标志物
血管钙化是糖尿病患者动脉粥样硬化的病理学标志(60)。目前研究结果提示过量的促钙化因子聚集和抑制钙化因子减少可能参与这一过程(61)。来自人外周血的循环成骨细胞在体内和体外都具有钙化的能力(62)。这些能够表达骨蛋白(如骨钙素和骨碱性磷酸酶)的细胞被认为是循环的骨祖细胞,并可能参与血管钙化和动脉粥样硬化。初步临床研究发现冠状动脉粥样硬化及动脉僵硬与骨髓来源细胞的成骨过程激活相关(63)。近期,实验证实了一种循环炎症性单核细胞的亚型,叫做骨髓钙化细胞(myeloid calcifying cells,MCCs)。这种细胞涉及血管钙化并在T2DM患者体内高表达。MCCs已经被报道具有抗血管生成作用,从而进一步导致糖尿病的血管疾病表型。因此,MCCs在糖尿病危险分层中可能作为一个重要的指标。
糖基化终产物(Advanced glycation end products,AGEs)
越来越多的证据显示AGEs可能成为糖尿病患者体内潜在心血管生物标志物。AGEs是一个广泛糖基化蛋白的大家族,并能够在动脉粥样硬化斑块中由于新陈代谢增加而形成(65)。目前关于动脉粥样硬化斑块中存在AGEs已经被广泛认识(66)。值得注意的是在实验模型中抑制AGEs的合成能够预防或者减轻动脉粥样硬化(67)。利用自发荧光反应检测糖尿病患者皮肤的AGEs含量可以为患者危险分级提供重要的信息。一项涉及972名糖尿病的调查显示将皮肤AGEs纳入UKPDS风险评估后,使得27%患者的危险等级发生改变:从低等级变为高等级(68)。同时研究发现在UKPDS风险评估>10%的糖尿病患者中当皮肤AGEs超过总体的中位数者其10年心血管事件发生率明显升高((56% vs. 39%)(68)。近期通过串联质谱法检测发现了两种主要的AGEs:甲基乙二醛衍生的5-氢-5甲基咪唑啉酮(methylglyoxal-derived 5-hydro-5-methylimidazolone ,MG-H1)和羧甲基化赖氨酸(Nε (carboxylmethyl) lysine,CML),它们在有症状颈动脉斑块的患者体内表达明显高于无症状者(69)。MG-H1和CML与IL-8和MCP-1等炎症细胞因子含量增高有关,并且和MMP-9活性增加相关,这提示AGEs也可为预测动脉粥样硬化斑块组成及稳定性提供信息。对于AGEs的认同是基于阻断它们的合成可以有效地缓解糖尿病相关的血管功能失调的病理学特征改变。通过交联阻断剂ALT-711降解AGEs可以降低动脉脉压和改善大动脉的顺应性(70)。利用苯磷硫胺可以阻断富AGE饮食所引起的微动脉或大动脉的内皮细胞功能失调和氧化应激反应(71)。基于以上的实验,AGEs的形成可能是引起血管炎症反应、氧化应激和最后斑块的不稳定性等的上游事件(67)。
综上所述,目前的证据显示发现大量生物标记物可以有助于糖尿病患者心血管疾病的预测。在研究的众多不同生物标记物中,AGEs可能是比较可靠的预测因素,其预测能力可能会超过传统的风险评估系统(68)。炎症性细胞因子(IL-6, TNF-α)以及C反应蛋白在T2DM病理生理起着重要的作用,但目前并没有实验数据显示炎症标志物具有独立的风险预测能力(44)。另一方面,目前需要大量前瞻性研究来进一步证实新出现的生物标记物如microRNAs、DNA甲基化和骨髓钙化细胞等预测风险的能力。
总结
尽管在预防措施、药物治疗及干预措施等方面有了很大的进步,但是心血管事件仍然是构成T2DM死亡率的首要因素。传统的危险因素,如高血压、肥胖及脂质紊乱,使得糖尿病和血管疾病之间具有密切关联性。然而,其他的病因学机制则涉及高血糖症、胰岛素抵抗和血管功能紊乱。在现有的综述里,我们目前认识到了一些关于糖尿病性血管疾病的新机制及其对临床的影响。因此,进一步的转化研究和大规模随机临床试验将为新的循环生物标志物在临床应用以及依赖机制的T2DM诊断和治疗策略提供证据。
Acknowledgements
声明: 作者与文中内容无利益冲突。
特别感谢译者:刘越和林芳,哈尔滨医科大学附属第一医院心内科,哈尔滨,中国。
References
- Després JP. Body fat distribution and risk of cardiovascular disease: an update. Circulation 2012;126:1301-13. [PubMed]
- Eckel RH, Kahn SE, Ferrannini E, et al. Obesity and type 2 diabetes: what can be unified and what needs to be individualized? J Clin Endocrinol Metab 2011;96:1654-63. [PubMed]
- Inzucchi SE, Bergenstal RM, Buse JB, et al. Management of hyperglycemia in type 2 diabetes: a patient-centered approach: position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2012;35:1364-79. [PubMed]
- Beckman JA, Paneni F, Cosentino F, et al. Diabetes and vascular disease: pathophysiology, clinical consequences, and medical therapy: part II. Eur Heart J 2013;34:2444-52. [PubMed]
- Napoli C, Crudele V, Soricelli A, et al. Primary prevention of atherosclerosis: a clinical challenge for the reversal of epigenetic mechanisms? Circulation 2012;125:2363-73. [PubMed]
- Liu L, Li Y, Tollefsbol TO. Gene-environment interactions and epigenetic basis of human diseases. Curr Issues Mol Biol 2008;10:25-36. [PubMed]
- Paneni F, Costantino S, Volpe M, et al. Epigenetic signatures and vascular risk in type 2 diabetes: a clinical perspective. Atherosclerosis 2013;230:191-7. [PubMed]
- Haffner SM, Lehto S, Rönnemaa T, et al. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med 1998;339:229-34. [PubMed]
- Wei M, Gaskill SP, Haffner SM, et al. Effects of diabetes and level of glycemia on all-cause and cardiovascular mortality. The San Antonio Heart Study. Diabetes Care 1998;21:1167-72. [PubMed]
- Fioretto P, Dodson PM, Ziegler D, et al. Residual microvascular risk in diabetes: unmet needs and future directions. Nat Rev Endocrinol 2010;6:19-25. [PubMed]
- ADVANCE Collaborative Group, Patel A, MacMahon S, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008;358:2560-72. [PubMed]
- ACCORD Study Group, Gerstein HC, Miller ME, et al. Long-term effects of intensive glucose lowering on cardiovascular outcomes. N Engl J Med 2011;364:818-28.. [PubMed]
- Gaede P, Vedel P, Larsen N, et al. Multifactorial intervention and cardiovascular disease in patients with type 2 diabetes. N Engl J Med 2003;348:383-93. [PubMed]
- Gaede P, Lund-Andersen H, Parving HH, et al. Effect of a multifactorial intervention on mortality in type 2 diabetes. N Engl J Med 2008;358:580-91. [PubMed]
- Arca M, Pigna G, Favoccia C. Mechanisms of diabetic dyslipidemia: relevance for atherogenesis. Curr Vasc Pharmacol 2012;10:684-6. [PubMed]
- Keech A, Simes RJ, Barter P, et al. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial. Lancet 2005;366:1849-61. [PubMed]
- ACCORD Study Group, Ginsberg HN, Elam MB, et al. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med 2010;362:1563-74. [PubMed]
- AIM-HIGH Investigators, Boden WE, Probstfield JL, et al. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy. N Engl J Med 2011;365:2255-67. [PubMed]
- Paneni F, Beckman JA, Creager MA, et al. Diabetes and vascular disease: pathophysiology, clinical consequences, and medical therapy: part I. Eur Heart J 2013;34:2436-43. [PubMed]
- Cornier MA, Marshall JA, Hill JO, et al. Prevention of overweight/obesity as a strategy to optimize cardiovascular health. Circulation 2011;124:840-50. [PubMed]
- Paneni F, Costantino S, Cosentino F. Insulin resistance, diabetes, and cardiovascular risk. Curr Atheroscler Rep 2014;16:419. [PubMed]
- Shenouda SM, Widlansky ME, Chen K, et al. Altered mitochondrial dynamics contributes to endothelial dysfunction in diabetes mellitus. Circulation 2011;124:444-53. [PubMed]
- Tabit CE, Shenouda SM, Holbrook M, et al. Protein kinase C-β contributes to impaired endothelial insulin signaling in humans with diabetes mellitus. Circulation 2013;127:86-95. [PubMed]
- Giacco F, Brownlee M. Oxidative stress and diabetic complications. Circ Res 2010;107:1058-70. [PubMed]
- Nishikawa T, Edelstein D, Du XL, et al. Normalizing mitochondrial superoxide production blocks three pathways of hyperglycaemic damage. Nature 2000;404:787-90. [PubMed]
- Paneni F, Mocharla P, Akhmedov A, et al. Gene silencing of the mitochondrial adaptor p66(Shc) suppresses vascular hyperglycemic memory in diabetes. Circ Res 2012;111:278-89. [PubMed]
- Geraldes P, King GL. Activation of protein kinase C isoforms and its impact on diabetic complications. Circ Res 2010;106:1319-31. [PubMed]
- Sun L, Xiao L, Nie J, et al. p66Shc mediates high-glucose and angiotensin II-induced oxidative stress renal tubular injury via mitochondrial-dependent apoptotic pathway. Am J Physiol Renal Physiol 2010;299:F1014-25. [PubMed]
- Quagliaro L, Piconi L, Assaloni R, et al. Intermittent high glucose enhances apoptosis related to oxidative stress in human umbilical vein endothelial cells: the role of protein kinase C and NAD(P)H-oxidase activation. Diabetes 2003;52:2795-804. [PubMed]
- Kouroedov A, Eto M, Joch H, et al. Selective inhibition of protein kinase Cbeta2 prevents acute effects of high glucose on vascular cell adhesion molecule-1 expression in human endothelial cells. Circulation 2004;110:91-6. [PubMed]
- Giorgio M, Migliaccio E, Orsini F, et al. Electron transfer between cytochrome c and p66Shc generates reactive oxygen species that trigger mitochondrial apoptosis. Cell 2005;122:221-33. [PubMed]
- Migliaccio E, Giorgio M, Mele S, et al. The p66shc adaptor protein controls oxidative stress response and life span in mammals. Nature 1999;402:309-13. [PubMed]
- Camici GG, Schiavoni M, Francia P, et al. Genetic deletion of p66(Shc) adaptor protein prevents hyperglycemia-induced endothelial dysfunction and oxidative stress. Proc Natl Acad Sci U S A 2007;104:5217-22. [PubMed]
- Pagnin E, Fadini G, de Toni R, et al. Diabetes induces p66shc gene expression in human peripheral blood mononuclear cells: relationship to oxidative stress. J Clin Endocrinol Metab 2005;90:1130-6. [PubMed]
- Paneni F, Volpe M, Lüscher TF, et al. SIRT1, p66(Shc), and Set7/9 in vascular hyperglycemic memory: bringing all the strands together. Diabetes 2013;62:1800-7. [PubMed]
- Ceriello A, Ihnat MA, Thorpe JE. Clinical review 2: The “metabolic memory”: is more than just tight glucose control necessary to prevent diabetic complications? J Clin Endocrinol Metab 2009;94:410-5. [PubMed]
- Frontoni S, Di Bartolo P, Avogaro A, et al. Glucose variability: An emerging target for the treatment of diabetes mellitus. Diabetes Res Clin Pract 2013;102:86-95. [PubMed]
- El-Osta A, Brasacchio D, Yao D, et al. Transient high glucose causes persistent epigenetic changes and altered gene expression during subsequent normoglycemia. J Exp Med 2008;205:2409-17. [PubMed]
- Baker RG, Hayden MS, Ghosh S. NF. -κB, inflammation, and metabolic disease. Cell Metab 2011;13:11-22. [PubMed]
- Johnson EL. Glycemic variability in type 2 diabetes mellitus: oxidative stress and macrovascular complications. Adv Exp Med Biol 2012;771:139-54. [PubMed]
- Monnier L, Mas E, Ginet C, et al. Activation of oxidative stress by acute glucose fluctuations compared with sustained chronic hyperglycemia in patients with type 2 diabetes. JAMA 2006;295:1681-7. [PubMed]
- Brownlee M, Hirsch IB. Glycemic variability: a hemoglobin A1c-independent risk factor for diabetic complications. JAMA 2006;295:1707-8. [PubMed]
- Paneni F. 2013 ESC/EASD guidelines on the management of diabetes and cardiovascular disease: Established knowledge and evidence gaps. Diab Vasc Dis Res 2014;11:5-10. [PubMed]
- Folsom AR, Chambless LE, Ballantyne CM, et al. An assessment of incremental coronary risk prediction using C-reactive protein and other novel risk markers: the atherosclerosis risk in communities study. Arch Intern Med 2006;166:1368-73. [PubMed]
- Authors/Task Force Members, Rydén L, Grant PJ, et al. ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD: the Task Force on diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and developed in collaboration with the European Association for the Study of Diabetes (EASD). Eur Heart J 2013;34:3035-87. [PubMed]
- Allan GM, Nouri F, Korownyk C, et al. Agreement among cardiovascular disease risk calculators. Circulation 2013;127:1948-56. [PubMed]
- Di Angelantonio E, Butterworth AS. Clinical utility of genetic variants for cardiovascular risk prediction: a futile exercise or insufficient data? Circ Cardiovasc Genet 2012;5:387-90. [PubMed]
- Cooper ME, El-Osta A. Epigenetics: mechanisms and implications for diabetic complications. Circ Res 2010;107:1403-13. [PubMed]
- Handy DE, Castro R, Loscalzo J. Epigenetic modifications: basic mechanisms and role in cardiovascular disease. Circulation 2011;123:2145-56. [PubMed]
- Luttmer R, Spijkerman AM, Kok RM, et al. Metabolic syndrome components are associated with DNA hypomethylation. Obes Res Clin Pract 2013;7:e106-e115. [PubMed]
- Abbott A. Project set to map marks on genome. Nature 2010;463:596-7. [PubMed]
- Gjesing AP, Pedersen O. ‘Omics’-driven discoveries in prevention and treatment of type 2 diabetes. Eur J Clin Invest 2012;42:579-88. [PubMed]
- Herder C, Karakas M, Koenig W. Biomarkers for the prediction of type 2 diabetes and cardiovascular disease. Clin Pharmacol Ther 2011;90:52-66. [PubMed]
- Quiat D, Olson EN. MicroRNAs in cardiovascular disease: from pathogenesis to prevention and treatment. J Clin Invest 2013;123:11-8. [PubMed]
- Zampetaki A, Kiechl S, Drozdov I, et al. Plasma microRNA profiling reveals loss of endothelial miR-126 and other microRNAs in type 2 diabetes. Circ Res 2010;107:810-7. [PubMed]
- Mocharla P, Briand S, Giannotti G, et al. AngiomiR-126 expression and secretion from circulating CD34(+) and CD14(+) PBMCs: role for proangiogenic effects and alterations in type 2 diabetics. Blood 2013;121:226-36. [PubMed]
- Jansen F, Yang X, Hoelscher M, et al. Endothelial microparticle-mediated transfer of MicroRNA-126 promotes vascular endothelial cell repair via SPRED1 and is abrogated in glucose-damaged endothelial microparticles. Circulation 2013;128:2026-38. [PubMed]
- Spranger J, Kroke A, Möhlig M, et al. Inflammatory cytokines and the risk to develop type 2 diabetes: results of the prospective population-based European Prospective Investigation into Cancer and Nutrition (EPIC)-Potsdam Study. Diabetes 2003;52:812-7. [PubMed]
- Geisler T, Mueller K, Aichele S, et al. Impact of inflammatory state and metabolic control on responsiveness to dual antiplatelet therapy in type 2 diabetics after PCI: prognostic relevance of residual platelet aggregability in diabetics undergoing coronary interventions. Clin Res Cardiol 2010;99:743-52. [PubMed]
- Avogaro A, Rattazzi M, Fadini GP. Ectopic calcification in diabetic vascular disease. Expert Opin Ther Targets 2014;18:595-609. [PubMed]
- Albiero M, Avogaro A, Fadini GP. Circulating Cellular Players in Vascular Calcification. Curr Pharm Des 2014. [Epub ahead of print]. [PubMed]
- Eghbali-Fatourechi GZ, Lamsam J, Fraser D, et al. Circulating osteoblast-lineage cells in humans. N Engl J Med 2005;352:1959-66. [PubMed]
- Flammer AJ, Gössl M, Widmer RJ, et al. Osteocalcin positive CD133+/CD34-/KDR+ progenitor cells as an independent marker for unstable atherosclerosis. Eur Heart J 2012;33:2963-9. [PubMed]
- Fadini GP, Albiero M, Menegazzo L, et al. Widespread increase in myeloid calcifying cells contributes to ectopic vascular calcification in type 2 diabetes. Circ Res 2011;108:1112-21. [PubMed]
- Jandeleit-Dahm K, Cooper ME. The role of AGEs in cardiovascular disease. Curr Pharm Des 2008;14:979-86. [PubMed]
- Basta G, Schmidt AM, De Caterina R. Advanced glycation end products and vascular inflammation: implications for accelerated atherosclerosis in diabetes. Cardiovasc Res 2004;63:582-92. [PubMed]
- Paneni F, Cosentino F. Advanced glycation endproducts and plaque instability: a link beyond diabetes. Eur Heart J 2014;35:1095-7. [PubMed]
- Meerwaldt R, Graaff R, Oomen PH, et al. Simple non-invasive assessment of advanced glycation endproduct accumulation. Diabetologia 2004;47:1324-30. [PubMed]
- Hanssen NM, Wouters K, Huijberts MS, et al. Higher levels of advanced glycation endproducts in human carotid atherosclerotic plaques are associated with a rupture-prone phenotype. Eur Heart J 2014;35:1137-46. [PubMed]
- Kass DA, Shapiro EP, Kawaguchi M, et al. Improved arterial compliance by a novel advanced glycation end-product crosslink breaker. Circulation 2001;104:1464-70. [PubMed]
- Stirban A, Negrean M, Stratmann B, et al. Benfotiamine prevents macro- and microvascular endothelial dysfunction and oxidative stress following a meal rich in advanced glycation end products in individuals with type 2 diabetes. Diabetes Care 2006;29:2064-71. [PubMed]


