皮下ICD——当前的证据和挑战
前言
皮下植入式心律转复除颤器(subcutaneous implantable cardioverter-defibrillator,S-ICD,图1)代表了ICD技术转型的范例。它最基本的优势是避免了经静脉系统的相关风险,尤其是在那些存在慢性血管内导线相关并发症风险的较年轻的患者中,它成为替代传统ICD的诱人选择。虽然目前尚无长期数据,但初步的研究已证实在有效性上,它替代经静脉器械是有希望并且可行的。然而,支持这一结论的文献受到质疑,争论在于S-ICD的技术和流行病学方面证据仍需进一步评估。
当前来自于EFFORTLESS和IDE研究的证据
EFFORTLESS研究是一项非随机,标准治疗,多中心注册研究,是第一项国际规模的评价皮下ICD的临床实用性和效果的研究。总共472名患者,前瞻性纳入241名患者,平均随访558天(13-1,342天,中位数498天),平均年龄49 ±18 岁(9-88岁)。在随访期间,有95名患者记录到317次自发室性心律失常,有169次接受了治疗,其中93次是室速(ventricular tachycardia,VT)/室颤(ventricular fibrillation, VF)。对于独立的VT/VF事件,第一次电击转复的效果是88%,在经过最多5次电击后,VT/VF临床转复的总体成功率达到100%。总体上,对于自发室性心律失常事件转复的有效率是96.1% (95% 可信限: 90.8-100%)。根据研究定义,有两次事件电击治疗失败(超出EGM存储时间之外的转复延迟和低感知引起一次新发事件),之后很快均转复成功。因此实际上,临床上达到了100%的转复率,所有独立的VT/VF均被转复为窦性心律。在39次非持续性VT(NSVT)/VF中,有37次持续时间短于初始的检测时间,因此未启动电击治疗。另外2次VT/VF在心律失常被检测到后自发终止,但触发了电击。在4名患者中发生了6次VT/VF风暴事件,导致了共40次室性心律失常发作。其中一名患者是Loeffler综合征,VF风暴之前是一段10分钟的心动过缓(在60秒停搏前的最低心率28次/分)。此后发生VF,除颤未成功,患者死亡。这一病例不寻常之处在于,患者左右心室心尖部大面积病变,被认为不适合于标准ICD系统。在植入时,曾正确感知到VF并予以65J电转复。S-ICD在360天中的不适当电击率为7%,主要原因是T波过感知(1)。
这些数据与FDA 器械调查豁免研究(IDE)的数据相似,这是另一项前瞻性非随机多中心试验,研究对象为具有ICD适应证且不需要起搏或未曾记录到起搏可终止的VT的成人(2)。研究纳入304名患者,证实即刻转复率几乎为100%,95%可信限的低限为98.8%,这超过了预先规定的≥88%的目标。总共119次自发VT/VF事件被电击治疗,其中38次独立的VT/VF发作,81次VT/VF风暴。在38次独立事件中,包括22次单形性VT和16次多形性VT/VF,共接受了43次恰当电击,成功终止了心律失常。38次事件中有35次(92.1%)一次转复成功,37次(97.4%)接受了一次或多次电击。一次单形性VT未被终止,在器械第二次充电时自行终止,之后同一名患者再次发作,一次电击成功终止。总共75%的VT/VF风暴被成功终止;一次电风暴由体外电击终止,因为当时器械正在充电,而患者情况危急。重要的是,没有报道心律失常死亡。此外,长期转复亚组研究证实65 J电击治疗可达到96%的成功率,其余VF被成功检测到,并以80 J转复成功(2)。这些结果表明S-ICD在即刻和慢性期终止心律失常均是有效的,此外,这些结果也被德国研究证实,这一研究表明S-ICD和经静脉ICD(TV-ICD)的第一次和第二次电击除颤效果是等同的(3)。这些研究也证实了S-ICD明确的临床效果,已突破了除颤阈值测试(defibrillation threshold testing ,DFT)和在真实世界中代谢紊乱的情况下使用的限制,这与TV-ICD相似,这支持S-ICD可以在更为广泛的患者群体中应用。
S-ICD植入的两切口和三切口技术
常规的S-ICD植入技术包括通过三个切口植入电极和器械:一个是制作侧方的囊袋,另两个是平行于胸骨的切口。电极由侧方的囊袋通过皮下隧道到达胸骨旁切口,并缝合固定于此处。值得注意的是,胸骨旁上方的切口容易暴露,因此容易受到感染,更容易引起不适, 较之其他部位切口,美观上可能也不易接受。Knops 等(4)描述了一种两切口的S-ICD植入技术,以避免胸骨旁上方的第三个切口,并证实其效果与三切口技术类似。在39名患者中应用了两切口植入技术,随访超过14个月,没有导线脱位或需重新植入的报道。仅有两例囊袋处浅表伤口感染,没有与植入技术相关的不适当感知。由于电极周围形成纤维组织,可提供额外的支持结构,因此长期导线脱位的可能性极小。此外,由于这一技术在年轻和活动更多的人群中进行了实验,因此可以可靠地推测在年龄较大的患者群中发生脱位相关并发症风险很低。
室性心律失常感知
在设计上,S-ICD感知系统不同于传统ICD。表1(5)中列出的是S-ICD和TV-ICD的主要差别。S-ICD有两个可程控的心动过速检测区:一个是室上性心动过速(SVT)识别区,另一个是VF区。然而,后者只能通过心室率进行鉴别;前者使用包括ECG形态和稳定性等参数在VT/VF和SVT之间进行鉴别。如果符合SVT鉴别标准,其心率低于VF治疗的心率阈值,则治疗被中止。如果患者在SVT时伴有束支阻滞,则这些算法可能无效,但这一问题可以通过根据筛查时记录的束支阻滞图形设置的ECG模板来解决。此时,除了持续监测心率,S-ICD可将心动过速时QRS波群和T波形态与植入后即刻记录和存储在其中的模板进行比较,从而在SVT和室性心律失常之间进行鉴别。为此,在植入前评估器械植入适应证和效果时,QRS-T波形态的筛查和分析是不可或缺的。例如,Olde Nordkampe等(7)随访了230名进行了QRS波群和T波形态筛查的患者,他们均无心脏起搏适应证,证实7.4%的患者不适合植入S-ICD。筛查失败的独立预测因子包括肥厚型心肌病【优势比(odds ratio,OR),12.6】,BMI增高(OR,15),QRS时限延长(OR,1.5)和标准12导联体表心电图中T波最大的导联上R:T比值小于3(OR,14.6)。因此S-ICD可能不适合于一小部分患者,但他们在人群中仍占相当比例,他们仍可从传统ICD中获益。此外,START研究证实S-ICD和TV-ICD在检测VF灵敏度上的等效性,但是与单腔和双腔TV-ICD相比,S-ICD在鉴别心律失常的特异性方面更占优势(8)。这与IDE研究中证实没有由于对房颤(atrial fibrillation ,AF)或SVT误分类导致不适当电击的结论一致,在EFFORTLESS研究中此类事件发生率也很低(9)。
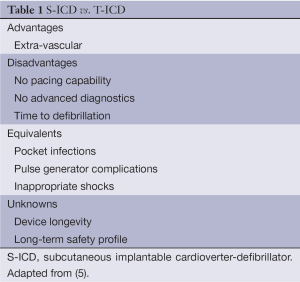
Full table
T波过感知最小化
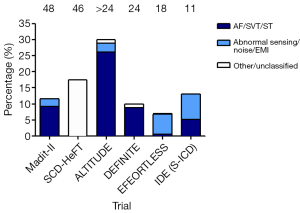
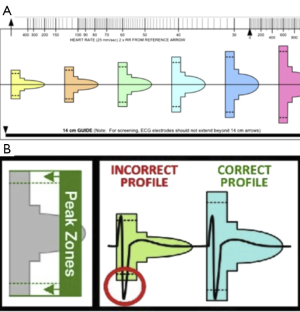
对于S-ICD,一个持续存在的挑战是T波过感知的问题,在过感知时,T波被错误识别为QRS波群,导致双重计数,从而引起不适当电击(图2)。随机对照研究表明这一现象的发生率是12-17%(12,14-16)。IDE研究报告在11个月的随访期中,13%的患者发生了不适当电击(2)。25名患者的不适当电击是由过感知导致,其中22次是由T波过感知所致。这一状况在应用双检测区程控时较单一检测区明显改善。EFFORTLESS研究结果与之相似,大部分不适当电击是由于心脏信号的过感知所致,仅仅只有4名患者不适当电击是由于噪音或电磁干扰(electromagnetic Interference,EMI),6名患者是由于SVT(1)。
为了解决这个问题,S-ICD制造厂商设计了筛查模板,以在植入前识别易发生过感知的患者(图3)(17)。Groh等(17)证实有8%的已植入ICD且无起搏事件的患者在筛查测试时失败,确认他们更易于出现T波过感知。特别是在缺血和心肌肥厚时,有23例在标准12导联体表ECG中Ⅰ、Ⅱ和avF导联出现T波倒置(T-wave inversions ,TWI),这更有可能出现筛查失败。然而有争议的是,TWI本身不会导致筛查失败,更为可能的原因是其伴随的ST段和T波形态改变,因为此时T波顶峰出现晚于T波直立时。其他更少见的原因包括QRS波群电压过大或过小,此时,QRS波群超出了这种算法的感知范围,或是因为电压太小而无法检测到。这必然需要S-ICD在感知算法上进行改进,以使算法在那些易于出现过感知的患者中更为可靠。实际上,Kooiman 等(18)发现可通过重新程控感知向量和/或应用运动获取模板的治疗区来减少不适当电击,这与START研究报道相一致(8)。
不适当电击治疗
尽管MADIT II研究显示预防性ICD植入改善了心肌梗死后射血分数降低患者的预后,但不适当电击仍是一个突出的问题。一项使用了相当严格标准的分析显示,在MADIT II队列中,有83/719名患者(11.5%)发生过一次或多次不适当电击,数据反映了所有184/590次(31.2%)电击中不适当电击的情况。不恰当治疗,包括电击和抗心动过速起搏(anti-tachycardia pacing,ATP),总体发生率为100/719(13.9%),其中17名患者为不适当ATP,而未发生不适当电击。房颤、SVT和异常感知是不适当治疗的最常见原因(分别为44%、36%和20%)。受到不适当电击的患者中,对其稳定性算法的程控频率较少(17% vs. 36%,P=0.030)。重要的是,不适当电击和不适当ATP伴有较高的全因死亡风险(风险比2.29,P=0.025)(16)。此外,最近另一项对MADIT-CRT队列的事后分析证实,适当电击和不适当电击的4年累积概率分别是13%和6%。另外,已证实那些发生了不适当电击的患者死亡率增加[风险比2.3(1.47-3.54),P19)。
有趣的是,S-ICD技术对限制自发的不适当电击是有利的。在IDE试验队列中,有226名患者为程控为两个电击治疗区,88名患者为一个电击治疗区。在2年中,双区和单区程控的亚组中,无不适当电击的比例分别是89.7%和73.6%(风险比0.38,P=0.001)。在两组中,适当电击无明显差别(20)。这一数据表明,综合QRS波群和T波形态的更有力的鉴别算法是有效的,并且不伴有不良后果,这一数据支持程控为两个电击区而非一个电击区。实际上,在S-ICD和TV-ICD的不适当电击率发生率相当。值得注意的是,在鉴别SVT上,S-ICD与TV-ICD相比有着更高的特异性(S-ICD 98%,单腔T-ICD 76.7%,双腔T-ICD 68%)(8)。
另一个需要长期关注的问题是电击诱发心肌损伤的可能性和继之出现的不良后果(21-24),尤其是与TV-ICD相比,S-ICD使用较高的电击能量(80J)。然而,对动物模型中心肌损伤生物标志物的研究表明,与TV-ICD相比,S-ICD电击引起的损伤更小(25),尽管由TV-ICD引起的心肌损伤已足以导致其他额外风险的结论仍有待证实。基于这一证据,在没有起搏适应证的患者中应优先考虑使用S-ICD而不是TV-ICD。另一方面,那些因为VT/VF受到电击的患者与没有经历过电击的患者相比有更高的死亡风险(13,26,27)。这与RCT研究所证实的ICD降低全因死亡的结论相矛盾。对这一明显矛盾的解释之一是受到电击的患者在初始时存在潜在致命心律失常的基础风险较高,ICD植入至少部分减少而不是导致了这种风险。此外,不适当电击通常发生于伴有其他独立不良后果的心律失常时,例如房颤和心力衰竭(28,29)。有资料证明,与真正需要治疗的心律失常引起的ICD电击伴有较高的死亡风险相反,那些由窦性心动过速、过感知或人工信号引起的ICD电击并不伴有死亡风险增加(30)。这支持异常心律而不是ICD电击导致了患者风险发生。此外,未能证实尝试通过诸如程控ICD、联合ATP治疗减少电击可降低死亡(31,32)。
抗心动过速起搏(ATP)和延迟治疗
对S-ICD缺少ATP功能是有争议的。ATP应用于ICD可避免对单形性VT发放电击。MADIT II证实了ICD治疗的长期持续获益(10),同时也证实在ICD植入后的4年中ICD治疗(ATP或电击)的累积概率为40%。另外一项研究显示在有心肌梗死和恶性室性心律失常病史的ICD植入者,有52%发生室性心律失常,其中绝大部分(670/671次事件)是持续单形性VT,ATP治疗的有效率达到96%(平均随访约2年)(33)。在心肌梗死后伴有收缩功能不全(LVEF<35%)的缺血性心肌病患者,ATP终止VT的有效率可高达93%。在总共214次VT发作中,仅有3%的VT无变化,2%的VT心率加速,2%治疗中止,1%伴有晕厥(34)。ATP虽然对于那些曾经有过VT,植入ICD作为二级预防的患者来说也是合适的,但是对于ICD来说这并不是一个必须的强制性功能,至少对于那些首次发作和很少复发VT的低危患者来说是这样的。SCD-HeFT 研究显示,在超过3年的随访中,仅仅1/3有VT病史的患者有过多于一次的发作,即每年风险为1.8%(21,35)。一项队列研究显示,在植入单腔或双腔ICD的患者中,植入后5年中,55.5%(95%可信限,52.0-59.0%)不需要起搏或ATP治疗,因此他们可作为植入S-ICD的候选者。ICD作为二级预防的患者中,具有严重心力衰竭和QRS间期延长者更有可能需要心室起搏,因此他们不建议作为S-ICD 植入的候选者(36)。此外,ATP不是没有风险,它有可能导致VT加速为多形性VT或VF(>37-39),这伴有较高的死亡风险(5)。较长的检测和释放电击所需时间也使VT事件自行终止的可能性更大,否则,这将会产生电击并被归类为“适当的治疗”。一项对心力衰竭患者中常规ICD询问中的快室率NSVT的分析显示这些事件中23%是多形性的(11)。起搏治疗快速室性心律失常减少电击[The Pacing Fast Ventricular Tachycardia Reduces Shock Therapies(Pain-FREE Rx II)]试验(40)显示随机化仅接受电击治疗的患者,有34%的快速VT事件在治疗前自发终止,表明在电击之前的ATP干预中有相当大比例是不必要的。然而,正如之前所讨论的那样,ATP治疗不增加死亡(16,19)。
与TV-ICD相比,S-ICD另一个需要关注的问题与治疗的启动和能量释放延迟有关,这是由于S-ICD算法需要较长的检测时间,释放65-80J能量也需要充电时间。来自于麻省总院的数据证明三种TV-ICD型号(圣犹达, n=117;波士顿科学,n=61;美敦力,n=116)的治疗时间是7.1±1.6 s(均数±标准差),与之相比,S-ICD的治疗时间是14.6±2.9 s。有趣的是,TV-ICD的5-95%区间较窄,为2.25-7.55 s,与之相比,S-ICD的5-95%区间呈明显的正偏态分布,其治疗时间范围大于24s(41)。测试中,88%的能量释放时间小于18s,95%的小于21s。考虑到S-ICD的充电时间大约为7s,这表明在超过10%的植入S-ICD患者中心律失常检测至少需要10s。相较于TV-ICD,对于S-ICD电击治疗中感知和能量传递延迟的时间延长是否不可接受,这一观点是有争议的。例如,尽管RELEVANT研究报道当识别程控为12/16次心搏时(42),与对照组相比,检测时间延长了6s,但在这些研究中报道的较长的检测时间并没有延长到在S-ICD中那样的程度。此外, MADIT-RIT研究显示在VF区,当检测时间由标准的1s延长至2.5s,治疗时间将增加1.5s,这仍然短于S-ICD的观察时间(43)。然而,较长的治疗时间降低了不必要电击的风险。例如,IDE研究证实,S-ICD的年死亡率为3.7%,这低于此前的临床研究,表明释放电击所需时间较长可能较少引起不良后果(44)。另一项研究证实尽管治疗延迟,但并不伴有晕厥事件的增加(40),尽管这是对于快速VT而不是VF,其电击时间也少于S-ICD的延迟时间。不过,MADIT-RIT证实,在平均随访超过1.4年的时间里,在快室率时启动治疗和延迟ICD治疗者伴有首次不适当治疗的减少(风险比:快室率与传统治疗:0.21;95%可信限,0.13-0.34;P43)。这一结论支持对ICD进行较为简单的程控而不是应用复杂的算法。S-ICD通过提供治疗的快室率区和延长检测至电击时间来模拟这一程控系统,从而减少不适当电击治疗。与在MADIT-RIT 研究中证实一定范围的检测时间延长有益(43),而IDE试验(2)表明适当治疗所需的时间也处于这一范围中。当然,这一获益有可能是因为心律失常的性质是良性的或是自行终止而不是未进行治疗,但恶性心律失常,如VF必须及时干预。实际上,在这种情况下,电击治疗延迟释放可能是致命的;一项报告显示三例中有两例针对VF的不适当治疗延迟至24秒和27秒。意料之中的是,两例均伴有晕厥(9)。为了减少此类治疗延迟,一种新的VF检测算法在自动获取阈值外形时使用了更为快速的斜率,以检测细颤波的VF,避免对SVT/VT向细颤波VF转变时检测不到。
VT/VF低感知最小化
另一个迄今尚未解决的问题,涉及到可能预测哪些病人存在对VF低感知而导致延迟治疗的风险的特征,对此类患者个体进行预先程控的可行性,以及延迟治疗影响成功除颤的阈值。实际上,IDE试验中2%的研究对象由于未完成VF复律测试或复律测试未成功,而未能成功植入S-ICD,10例未能完成复律测试程序,总共有11例受到的失败电击超过一次(2)。另外一项近期的研究报告了在S-ICD的除颤测试中有10%失败,尽管与对照组相当(3),但高于以前TV-ICD的数据(46)。尚不清楚影响DFT的因素是否也适用于S-ICD,与TV-ICD相比,仍缺乏这方面的证据基础。
并发症
S-ICD并非可避免传统ICD中感染和导线位置不佳的并发症。不过,在IDE研究的植入程序中,180天无器械相关并发症的比率是92.1%,可信限的低限为88.9%,高于研究前所指定的目标。EFFORTLESS 报告了在植入后头30天内,有14例患者(3%)中发生了15起系统相关并发症,相当于围术期无并发症率为97%。在植入后360天,记录系统或无植入相关并发症比率为94%。IDE和EFFORTLESS研究中感染率分别为5.7%和4%,IDE研究中1.3%的病例需要拔除,而在EFFORTLESS研究中为2.2%。不过,随着时间推移和经验增加,通过在运动时对T波过感知进行优化筛查,使用缝合套筒防止导线移位并减少植入时间,并发症发生率有所改善(47)。
S-ICD的候选患者
适合植入ICD的患者通常伴有其他明显的心脏疾患,如心力衰竭、低射血分数或是束支阻滞必须进行心脏再同步化治疗或起搏治疗。研究证实,ICD升级为CRT-D的比例在5%-42%之间(48-50),S-ICD的应用被严格限制在没有或不太可能进展为起搏适应证的患者。此外,S-ICD没有ATP功能,对那些有单形性VT病史的患者应予以谨慎考虑。对那些静脉途径存在困难,或是有免疫功能不全的患者,为使感染风险最小,S-ICD是TV-ICD的简化选择(51)。年轻患者因静脉通路反复使用导致长期并发症风险增加,及那些有猝死风险者,例如,患有Brugada综合征和长QT综合征的患者也可能从S-ICD中获益。尽管Brugada综合征中存在由于QRS波群和T波形态特征带来双重计数和不适当治疗的额外风险,但病例报告已证实在这一人群中能够成功植入S-ICD并有效终止VF而不导致不良后果,其前提是预先进行仔细而恰当的植入前筛查(52)。另一方面,在Brugada综合征中不适当电击由室上性心动过速所致可能更为常见,尤其是AF,这随着随访时间延长更为明显(53)。当然,根据上述,尤其是当考虑到长期治疗效果以及T波过感知时,S-ICD是否同TV-ICD一样有效仍是个问题。不过,有证据表明,S-ICD在心肌病患者中用于一级预防以及在有VT/VF病史患者中用于二级预防的情况在增加(47)。因此认为,对于状态相对良好的患者的一级预防,S-ICD可作为传统ICD的合理替代,因为S-ICD足以在需要时挽救患者生命,而无经静脉导线的不利之处。
未来的方向
S-ICD同时代表了与植入式TV-ICD相关的侵入式治疗的进展水平,是未来潜在的发展方向。NanostimTM(圣犹达医疗)是发展的最好例子,这是比AAA电池还小的一个圆柱体器械,是第一款独立的能够经皮植入的无导线起搏器(leadless pacemaker,LCP)(54,55)。这一技术可能终将替代传统起搏技术,象传统双腔ICD那样,通过结合心内电图数据,对照SVT模板以确认VT,从而改善S-ICD的感知功能。随着电池技术进展,以及对当下S-ICD的重新设计,发生器容积减少,将能增加在儿科患者中的舒适度和适应性。根据对于IDE和EFFORTLESS队列中事件的分析,系统所应用的算法在不断地进行回顾和修正。重要的一步将是能够结合所有三个导联向量的数据自动将T波过感知最小化。例如可在需要运动时避免不适当电击。可以想象远程监测将优化随访,并能够检测一过性的过感知事件从而能够前瞻性地重新程控,以避免不适当电击,并且还能对亚临床心律失常,如AF和NSVT进行相应的处理。
结论
S-ICD的效果和有望替代传统ICD的临床价值已得到证实,尤其是在较年轻的患者中可避免经静脉植入导线的长期风险。最初的试验显示其除颤成功率和不适当电击与传统模式相似,随着技术改进,尤其是使用双区和运动基础上的程控,这将进一步得到改善。不过,研究(NCT01296022)(前瞻性、随机对照经皮和经静脉植入式心律转复除颤器治疗——PRAETORIAN)的结果备受期待,它将有力评估S-ICD的不适当电击和并发症发生率(56)。尽管初步研究很有前景,但S-ICD在治疗遗传性心律失常中的长期作用仍不清楚。正如传统ICD一样,S-ICD的下一代脉冲发生器将会更加小型化,采用无线模式并能够进行远程随访。当然,尽管能够根据个体风险进行个体化治疗,但在目前,S-ICD仍不能完全替代TV-ICD。在非起搏依赖的较年轻患者中,S-ICD中作为一级预防的可行替代正在确立它的地位,并可作为减少猝死的一种有价值的补充手段而被接受。
声明
披露:Lambiase医生接受波士顿科学的教育拨款和讲者费用及美敦力公司的教育拨款。并且受到伦敦大学医学院生物医学卫生研究院支持。
References
- Lambiase PD, Barr C, Theuns DA, et al. Worldwide experience with a totally subcutaneous implantable defibrillator: early results from the EFFORTLESS S-ICD Registry. Eur Heart J 2014;35:1657-65. [PubMed]
- Weiss R, Knight BP, Gold MR, et al. Safety and efficacy of a totally subcutaneous implantable-cardioverter defibrillator. Circulation 2013;128:944-53. [PubMed]
- Köbe J, Reinke F, Meyer C, et al. Implantation and follow-up of totally subcutaneous versus conventional implantable cardioverter-defibrillators: a multicenter case-control study. Heart Rhythm 2013;10:29-36. [PubMed]
- Knops RE, Olde Nordkamp LR, de Groot JR, et al. Two-incision technique for implantation of the subcutaneous implantable cardioverter-defibrillator. Heart Rhythm 2013;10:1240-3. [PubMed]
- Saxon LA. The subcutaneous implantable defibrillator: a new technology that raises an existential question for the implantable cardioverter-defibrillator. Circulation 2013;128:938-40. [PubMed]
- Lambiase PD, Srinivasan NT. Early experience with the subcutaneous ICD. Curr Cardiol Rep 2014;16:516. [PubMed]
- Olde Nordkamp LR, Warnaars JL, Kooiman KM, et al. Which patients are not suitable for a subcutaneous ICD: incidence and predictors of failed QRS-T-wave morphology screening. J Cardiovasc Electrophysiol 2014;25:494-9. [PubMed]
- Gold MR, Theuns DA, Knight BP, et al. Head-to-head comparison of arrhythmia discrimination performance of subcutaneous and transvenous ICD arrhythmia detection algorithms: the START study. J Cardiovasc Electrophysiol 2012;23:359-66. [PubMed]
- Jarman JW, Todd DM. United Kingdom national experience of entirely subcutaneous implantable cardioverter-defibrillator technology: important lessons to learn. Europace 2013;15:1158-65. [PubMed]
- Goldenberg I, Gillespie J, Moss AJ, et al. Long-term benefit of primary prevention with an implantable cardioverter-defibrillator: an extended 8-year follow-up study of the Multicenter Automatic Defibrillator Implantation Trial II. Circulation 2010;122:1265-71. [PubMed]
- Chen J, Johnson G, Hellkamp AS, et al. Rapid-rate nonsustained ventricular tachycardia found on implantable cardioverter-defibrillator interrogation: relationship to outcomes in the SCD-HeFT (Sudden Cardiac Death in Heart Failure Trial). J Am Coll Cardiol 2013;61:2161-8. [PubMed]
- Schaechter A, Kadish AH; DEFibrillators In Non-Ischemic Cardiomyopathy Treatment Evaluation. DEFibrillators In Non-Ischemic Cardiomyopathy Treatment Evaluation (DEFINITE). Card Electrophysiol Rev 2003;7:457-62. [PubMed]
- Saxon LA, Hayes DL, Gilliam FR, et al. Long-term outcome after ICD and CRT implantation and influence of remote device follow-up: the ALTITUDE survival study. Circulation 2010;122:2359-67. [PubMed]
- Poole JE, Gold MR. Who should receive the subcutaneous implanted defibrillator?: The subcutaneous implantable cardioverter defibrillator (ICD) should be considered in all ICD patients who do not require pacing. Circ Arrhythm Electrophysiol 2013;6:1236-44; discussion 1244-5. [PubMed]
- Piccini JP, Al-Khatib SM, Hellkamp AS, et al. Mortality benefits from implantable cardioverter-defibrillator therapy are not restricted to patients with remote myocardial infarction: an analysis from the Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT). Heart Rhythm 2011;8:393-400. [PubMed]
- Daubert JP, Zareba W, Cannom DS, et al. Inappropriate implantable cardioverter-defibrillator shocks in MADIT II: frequency, mechanisms, predictors, and survival impact. J Am Coll Cardiol 2008;51:1357-65. [PubMed]
- Groh CA, Sharma S, Pelchovitz DJ, et al. Use of an electrocardiographic screening tool to determine candidacy for a subcutaneous implantable cardioverter-defibrillator. Heart Rhythm 2014;11:1361-6. [PubMed]
- Kooiman KM, Knops RE, Olde Nordkamp L, et al. Inappropriate subcutaneous implantable cardioverter-defibrillator shocks due to T-wave oversensing can be prevented: implications for management. Heart Rhythm 2014;11:426-34. [PubMed]
- Sood N, Ruwald AC, Solomon S, et al. Association between myocardial substrate, implantable cardioverter defibrillator shocks and mortality in MADIT-CRT. Eur Heart J 2014;35:106-15. [PubMed]
- Gold MR, Weiss R, Theuns DA, et al. Use of a discrimination algorithm to reduce inappropriate shocks with a subcutaneous implantable cardioverter-defibrillator. Heart Rhythm 2014;11:1352-8. [PubMed]
- Poole JE, Johnson GW, Hellkamp AS, et al. Prognostic importance of defibrillator shocks in patients with heart failure. N Engl J Med 2008;359:1009-17. [PubMed]
- Larsen GK, Evans J, Lambert WE, et al. Shocks burden and increased mortality in implantable cardioverter-defibrillator patients. Heart Rhythm 2011;8:1881-6. [PubMed]
- Deyell MW, Qi A, Chakrabarti S, Yeung-Lai-Wah JA, et al. Prognostic impact of inappropriate defibrillator shocks in a population cohort. Heart 2013;99:1250-5. [PubMed]
- Raitt MH. Reducing shocks and improving outcomes with implantable defibrillators. JAMA 2013;309:1937-8. [PubMed]
- Killingsworth CR, Melnick SB, Litovsky SH, et al. Evaluation of acute cardiac and chest wall damage after shocks with a subcutaneous implantable cardioverter defibrillator in Swine. Pacing Clin Electrophysiol 2013;36:1265-72. [PubMed]
- Moss AJ, Greenberg H, Case RB, et al. Long-term clinical course of patients after termination of ventricular tachyarrhythmia by an implanted defibrillator. Circulation 2004;110:3760-5. [PubMed]
- Saxon LA, Bristow MR, Boehmer J, et al. Predictors of sudden cardiac death and appropriate shock in the Comparison of Medical Therapy, Pacing, and Defibrillation in Heart Failure (COMPANION) Trial. Circulation 2006;114:2766-72. [PubMed]
- Swedberg K, Olsson LG, Charlesworth A, et al. Prognostic relevance of atrial fibrillation in patients with chronic heart failure on long-term treatment with beta-blockers: results from COMET. Eur Heart J 2005;26:1303-8. [PubMed]
- Olsson LG, Swedberg K, Ducharme A, et al. Atrial fibrillation and risk of clinical events in chronic heart failure with and without left ventricular systolic dysfunction: results from the Candesartan in Heart failure-Assessment of Reduction in Mortality and morbidity (CHARM) program. J Am Coll Cardiol 2006;47:1997-2004. [PubMed]
- Powell BD, Saxon LA, Boehmer JP, et al. Survival after shock therapy in implantable cardioverter-defibrillator and cardiac resynchronization therapy-defibrillator recipients according to rhythm shocked. The ALTITUDE survival by rhythm study. J Am Coll Cardiol 2013;62:1674-9. [PubMed]
- Saxon LA, Varma NJ, Lindenfeld J, et al. ICD programming trends and relationship to survival: the Altitude Study Group. Heart Rhythm 2013;10:1420-1.
- Ha AH, Ham I, Nair GM, et al. Implantable cardioverter-defibrillator shock prevention does not reduce mortality: a systemic review. Heart Rhythm 2012;9:2068-74. [PubMed]
- Mont L, Valentino M, Sambola A, et al. Arrhythmia recurrence in patients with a healed myocardial infarction who received an implantable defibrillator: analysis according to the clinical presentation. J Am Coll Cardiol 1999;34:351-7. [PubMed]
- Oliveira M, Antunes E, da Silva N, et al. Antitachycardia pacing in patients with left ventricular dysfunction and hemodynamically unstable arrhythmias. Rev Port Cardiol 1999;18:161-6. [PubMed]
- Hanna R, Hellkamp A, Mark D, et al. Predictors of ventricular tachyarrhythmias treated with the ICD in the sudden cardiac death in heart failure trial. Poster, ESC Congress 2012. Munich, Germany, August 26, 2012.
- de Bie MK, Thijssen J, van Rees JB, et al. Suitability for subcutaneous defibrillator implantation: results based on data from routine clinical practice. Heart 2013;99:1018-23. [PubMed]
- Sweeney MO, Wathen MS, Volosin K, et al. Appropriate and inappropriate ventricular therapies, quality of life, and mortality among primary and secondary prevention implantable cardioverter defibrillator patients: results from the Pacing Fast VT REduces Shock ThErapies (PainFREE Rx II) trial. Circulation 2005;111:2898-905. [PubMed]
- Wathen MS, Sweeney MO, DeGroot PJ, et al. Shock reduction using antitachycardia pacing for spontaneous rapid ventricular tachycardia in patients with coronary artery disease. Circulation 2001;104:796-801. [PubMed]
- Young JB, Abraham WT, Smith AL, et al. Combined cardiac resynchronization and implantable cardioversion defibrillation in advanced chronic heart failure: the MIRACLE ICD Trial. JAMA 2003;289:2685-94. [PubMed]
- Wathen MS, DeGroot PJ, Sweeney MO, et al. Prospective randomized multicenter trial of empirical antitachycardia pacing versus shocks for spontaneous rapid ventricular tachycardia in patients with implantable cardioverter-defibrillators: Pacing Fast Ventricular Tachycardia Reduces Shock Therapies (PainFREE Rx II) trial results. Circulation 2004;110:2591-6. [PubMed]
- Rav Acha M, Milan D. Who should receive the subcutaneous implanted defibrillator?: Timing is not right to replace the transvenous implantable cardioverter defibrillator. Circ Arrhythm Electrophysiol 2013;6:1246-51; discussion 1251. [PubMed]
- Gasparini M, Menozzi C, Proclemer A, et al. A simplified biventricular defibrillator with fixed long detection intervals reduces implantable cardioverter defibrillator (ICD) interventions and heart failure hospitalizations in patients with non-ischaemic cardiomyopathy implanted for primary prevention: the RELEVANT [Role of long dEtection window programming in patients with LEft VentriculAr dysfunction, Non-ischemic eTiology in primary prevention treated with a biventricular ICD] study. Eur Heart J 2009;30:2758-67. [PubMed]
- Moss AJ, Schuger C, Beck CA, et al. Reduction in inappropriate therapy and mortality through ICD programming. N Engl J Med 2012;367:2275-83. [PubMed]
- Gasparini M, Proclemer A, Klersy C, et al. Effect of long-detection interval vs standard-detection interval for implantable cardioverter-defibrillators on antitachycardia pacing and shock delivery: the ADVANCE III randomized clinical trial. JAMA 2013;309:1903-11. [PubMed]
- Russo AM, Sauer W, Gerstenfeld EP, et al. Defibrillation threshold testing: is it really necessary at the time of implantable cardioverter-defibrillator insertion? Heart Rhythm 2005;2:456-61. [PubMed]
- Swerdlow CD, Russo AM, Degroot PJ. The dilemma of ICD implant testing. Pacing Clin Electrophysiol 2007;30:675-700. [PubMed]
- Olde Nordkamp LR, Dabiri Abkenari L, Boersma LV, et al. The entirely subcutaneous implantable cardioverter-defibrillator: initial clinical experience in a large Dutch cohort. J Am Coll Cardiol 2012;60:1933-9. [PubMed]
- Cleland JG, Daubert JC, Erdmann E, et al. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med 2005;352:1539-49. [PubMed]
- Moss AJ, Hall WJ, Cannom DS, et al. Cardiac-resynchronization therapy for the prevention of heart-failure events. N Engl J Med 2009;361:1329-38. [PubMed]
- Scott PA, Whittaker A, Zeb M, et al. Rates of upgrade of ICD recipients to CRT in clinical practice and the potential impact of the more liberal use of CRT at initial implant. Pacing Clin Electrophysiol 2012;35:73-80. [PubMed]
- Tompkins C, McLean R, Cheng A, et al. End-stage renal disease predicts complications in pacemaker and ICD implants. J Cardiovasc Electrophysiol 2011;22:1099-104. [PubMed]
- De Maria E, Cappelli S, Cappato R. Shock efficacy of the entirely subcutaneous defibrillator for termination of spontaneous ventricular fibrillation in Brugada syndrome. Heart Rhythm 2013;10:1807-9. [PubMed]
- Rosso R, Glick A, Glikson M, et al. Outcome after implantation of cardioverter defibrillator [corrected] in patients with Brugada syndrome: a multicenter Israeli study (ISRABRU). Isr Med Assoc J 2008;10:435-9. [PubMed]
- Koruth JS. Feasibility and Efficacy of Percutaneously Delivered Leadless Cardiac Pacing in an In Vivo Ovine Model. Presented at Heart Rhythm 34th Annual Scientific Sessions. Denver, Colorado, USA. 2013. Available online: http://ondemand.hrsonline.org/Common/presentation-detail.aspx/8/23/1072/7301
- Reddy VY, Knops RE, Sperzel J, et al. Permanent leadless cardiac pacing: results of the LEADLESS trial. Circulation 2014;129:1466-71. [PubMed]
- Olde Nordkamp LR, Knops RE, Bardy GH, et al. Rationale and design of the PRAETORIAN trial: a Prospective, RAndomizEd comparison of subcuTaneOus and tRansvenous ImplANtable cardioverter-defibrillator therapy. Am Heart J 2012;163:753-760.e2.
特别感谢译者:孙凌,女,无锡明慈心血管医院,主治医师。2007年于新疆医科大学获心血管内科博士。从事心律失常及心力衰竭临床工作。