DPP-4 inhibitors, heart failure and type 2 diabetes: all eyes on safety
患有心衰的2型糖尿病患者
心衰是2型糖尿病患者常发生的疾病(1,2)。糖尿病男性和女性的心衰发病率是正常人的6-8倍,在女性实验组观察到最高的病例数(3)。在心衰患者中,15-26 %患有糖尿病,从而增加了心衰患者的发病率和死亡率(4-6)。最近研ATLAS 究显示患有心衰糖尿病患者比率可达20%(7)。由于一些发生机制的共存,心衰伴有糖尿病患者的发病率及死亡率的进一步上升,这些机制包括神经内分泌轴的干扰以及糖尿病患者心肌结构及功能的异常(8)。约五分之一慢性心衰患者患有糖尿病,这种比率在恶性心衰患者中可达40%(5)。射血分数保留的心衰及射血分数降低的心衰患病风险在2型糖尿病患者中皆有上升(9)。值得注意的是,前瞻性分析显示诊断为射血分数保留的心衰患者与射血分数降低的心衰患者相比,五年之后的死亡率高出50-60%(10)。最近的数据显示,患有射血分数保留心衰的糖尿病患者与非糖尿病患者相比,心衰的住院率或心衰死亡率更高(分别是30.9%与19%)。在调整相关因素后估计有68%的风险增长(调整的风险比1.68,95%可信区域1.26-2.25,P<0.001)(11)。尽管接受与非糖尿病患者相同的护理,患有心衰的糖尿病患者的预后也不理想(5)。这可能是在糖尿病患者体内,高血糖和胰岛素的抵抗会明显扩大微血管病变,细胞内钙处理的缺陷以及降低心肌脂质摄取从而导致代谢紊乱,线粒体供能不足和严重的心肌功能障碍(8)。
血糖控制会降低糖尿病患者心衰风险?
一些研究表明糖化血红蛋白水平显示的血糖控制不良可能与心衰风险增加相关。UKPDS研究显示,包括新诊断的糖尿病患者,长期的血糖控制与心衰风险有显著的关联。在这项研究中,患者的糖化血红蛋白水平从大于10%降到低于6%,患者中的心衰发生率则随之从每年11.9个事件/ 100人减少到2.3个事件/ 100人。这证明了糖化血红蛋白水平的降低与心衰风险之间成近线性关系(12)。不幸的是,这些数据与最近的随机对照试验ACCORD, ADVANCE and VADT的结果并不相符,这些试验验证了血糖控制会对微血管和大血管造成不好的影响(13)。在这些研究中,目标糖化血红蛋白值达到(<7%)与降低心衰相关的住院治疗率无关。同样令人失望是,最近的一项包括37229名患者,7项随机对照试验的meta分析显示,心衰相关的风险事件在强化血糖水平控制与标准治疗(优势比为1.20,95% 可信区域为 0.96-1.48)后没有显著差异,粗略的效果估计有高度异质性(14)。 事实上,其中4个试验高度使用了噻唑烷二酮类药物(例如 PRO活性, ACCORD, VADT, 和 RECORD),强化血糖控制后在随机个体人群中评估心衰风险。其它的3个保留试验(例如UKPDS, ADVANCE, 和VA-CSDM),风险率接近无,可信度过大,从而表明了可利用数据的局限性(风险率0.96,95%可信区域0.81-1.13)(14)。
因此,很难确定高血糖与心衰相关性,需要进一步的研究。与此Meta分析相反的是,先前包括25,958名男性及22,900名女性的2型糖尿病患者的队列研究证明,糖化血红蛋白每上升1%,心衰风险上升8%(95%可信区域5%到12%)(15)。 在这项研究中,HbA1c≥10,相对于HbA1c<10患者的心衰风险增加了1.56倍(95%可信区域1.26-1.93)。同样,在Reykjavik的研究中,空腹血糖水平的增加与心衰的发病率呈现出一个线性和独立的关系(16)。最近, Held 等证明了在一个包含31546名患心血管疾病风险高的受试者,平均随访时间为2.4年的临床队列试验中,无论是否患有糖尿病,糖代谢异常是一个独立的心衰住院预测因子(17)。总的来说,这些数据表明,血糖负担可能对心衰的发生和住院起着重要作用,降糖药物的选择可能会影响糖尿病患者的心衰风险。
DDP-4抑制剂近期应用案例
可抗糖尿病药物对于高血糖的控制是有效的,但是很多糖尿病患者伴有心血管(CV)的问题,应注意不同配方的风险/效益比(18)。噻唑烷二酮类,即罗西格列酮,与许多并发症包括膀胱癌,骨骨折,液体潴留致体重增加,以及心衰的发生都有关系(13)。此外ORIGIN试验表明胰岛素虽然没有影响心衰的发病率,但可能会导致体液潴留(19)。
在探索新的降糖治疗方案时,一项随机试验表明与安慰剂组相比较,使用DDP-4抑制剂治疗糖尿病患者增加了心衰住院的风险(20)。在解释临床研究结果之前,我们适当地提及DPP-4抑制剂的药理作用以及支持这类药物对心血管有益处的实验背景。
DPP-4抑制剂阻断胰高血糖素样肽-1(GLP-1),抑胃肽(GIP)和各种其他肽,包括脑钠肽的降解。因此,这些药物提高了胰高血糖素样肽-1 /抑胃肽的含量从而增强了葡萄糖的促胰岛素释放作用(21)。实验结果也支持这一观点,DPP-4抑制剂是心肌损伤的重要驱动因素(22)。事实上,DPP-4基因缺失的心肌梗死(MI)小鼠显示出较高的生存率(23,24)。这种现象可解释为磷酸化Akt蛋白,磷酸化糖原合成酶激酶以及心房利钠肽在DPP-4基因缺失的心脏中表达增加。有趣的是,使用DPP-4抑制剂西他列汀治疗能够囊括这些分子的变化,从而防止心肌缺血性损伤(23)。因此,依据多巴酚丁胺负荷超声心动图评估,2型糖尿病或无2型糖尿病患者服用西他列汀,对恢复缺血心肌有明显的治疗作用(25)。总之,这些数据表明,基于在心力衰竭和心肌缺血时对心肌起到保护作用, DPP-4抑制剂的使用可能成为一个有吸引力的治疗方法(21)。
借鉴于SAVOR-TIMI 53 和 EXAMINE 试验的教训
目前的证据表明,这样的实验结果在某种程度上是“在翻译中迷失”。事实上,最近的临床试验进行了DPP-4抑制剂对心血管影响的测试,不仅没有显示出任何相关的心血管益处,反而表明DPP-4抑制剂的使用与心衰住院率增加的相关性(20)。
在savor-timi 53试验中,16492例2型糖尿病患者中不管是有心血管病史还是心血管高风险患者随机接受沙格列汀或安慰剂,并接受平均2.1年的随访(表1)(26)。沙格列汀组发生主要终点事件的有613例,安慰剂组有609例(分别为7.3%和7.2%,风险比率1,95% 可信区域 0.89-1.12;P = 0.99为优势;P<0.001有意义)。综合了心血管死亡,心肌梗死,中风,不稳定型心绞痛(UA)住院,冠状动脉血运重建或者心衰的次要终点事件,发生在沙格列汀组和安慰剂组分别是1034例和1059例(分别为12.8%和12.4%,风险比率 1.02,95% 可信区域0.94—1.11;P= 0.66)。 令人讶异的是,与安慰剂组相比,沙格列汀组有更多患者因心衰而住院治疗(3.5%比2.8%;风险比率1.27,95% 可信区域1.07-1.51;P = 0.007)(26)。12个月的相应比率为1.9%比1.3%(风险比率1.46,95% 可信区域1.15-1.88;P = 0.002),此后无明显差异(随时间变化的相互作用,P= 0.017)。然而,这些研究结果与患者服用沙格列汀导致心衰死亡的人数随之增加是不平行的(在沙格列汀安慰剂组分别为44和40例)(26)。最大风险的因素为入院前有心衰,估计肾小球滤过率≤60毫升/分钟,或N末端前B型钠尿肽基线水平升高。没有证据表明N-末端前B型脑钠肽与沙格列汀之间存在异质性(交互作用P = 0.46),虽然心衰患者中服用过量的沙格列汀有绝对的风险,前B型钠尿肽表现出数值最大(风险比率1.31;95%可信区域1.04-1.66;P = 0.02),而最低的前B型钠尿肽数值与任何治疗差异无关(0.6%和0.6%,风险比率 0.84,95% 可信区域0.46-1.52;P = 0.56)(29)。 另外值得关注的是血糖状态在两组之间的差异。虽是血糖平衡研究,但在给予沙格列汀组和安慰剂组患者中,空腹血糖和糖化血红蛋白有着明显不同。与这一数据线相一致,大量的小规模(P=0.002) 及主要的 (P=0.047) 低血糖发作发生在沙格列汀组(表1)。
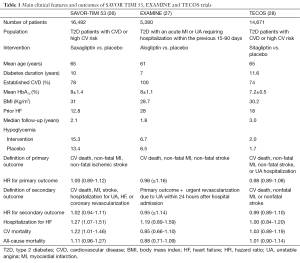
Full table
在EXAMINE试验中,5380例2型糖尿病患者及急性冠脉综合征患者在前90天,均随机给予DPP-4抑制剂阿格列汀治疗或安慰剂(27)。这项双盲,非劣效性试验经过平均时间为四年的随访后数据显示了主要及次要的心血管终点事件在阿格列汀组和安慰剂组之间的无明显差异。 对比SAVOR-TIMI 53试验,就心衰而言,此试验结果并无差异。阿格列汀组比较安慰剂组有7%不显著的增加。然而,后期分析表明有心衰迹象的患者服用DPP-4抑制剂后心衰发生率增加了(风险比率 1.76, 95%可信区域1.07-2.90)(13,30)。从SAVOR-TIMI 53试验观察结果来看,EXAMINE试验数据证实,B型钠尿肽浓度达到基线水平顶端的患者心衰入院风险最高(30)。EXAMINE试验相比于SAVOR试验样本量构成较小(5380对16492例),所以对心衰住院率缺乏统计学意义(31)。因此,这项研究就次要终点而言可能没有足够的说服力。沿着这条思路,最近的一项包括EXAMINE试验和SAVOR试验的meta分析证实DPP-4抑制剂应用使心衰相关住院率增加了25%(32)。总的来说,这些数据可能表明,DPP-4抑制剂应用使心衰住院风险的增加是一个实际存在的、先前未知的副作用。几种神经内分泌轴的变化,即P物质(SP)、神经肽Y(NP-Y)的变化,这个公认的机制可能有助于解释DDP-4抑制剂的应用使心衰住院的风险增加(28)。针对代谢综合征患者的一项最新研究表明,在给予安慰剂、低剂量的ACE抑制剂同时(5毫克依那普利),给予西他列汀能降低血压(33)。然而,这种趋势在高剂量的血管紧张素转换酶抑制剂的应用后被逆转。这些发现使作者推测,患者在服用西他列汀联合高剂量的ACE抑制剂后,高水平的P物质可促进交感神经紧张,从而起到减轻血压降低的作用(33)。事实上,P物质和神经肽Y对于DPP-4抑制是有害的生物产物,可能引发交感神经紧张,因此,使2型糖尿病患者的心衰恶化。在此,SAVOR-TIMI 53试验分析表明,不应用ACE抑制剂的2型糖尿病患者(风险比率 1.42;95% C可信区域1.09-1.88)的心衰住院风险要高于服用这类药物的患者(风险比率1.18;95% 可信区域0.94-1.48)(20)。但仍需要更长时间和更多前瞻性研究来证明这些新发现。
安全性的关注:TECOS试验
基于这些安全问题,国际监管机构已经要求DDP-4抑制剂——以及其他新的降糖药物——不仅显示降血糖能力,也不能与临床主要的心血管事件发生率的上升有关系。在这方面,主要关注的是,心衰恶化是否由DPP-4抑制剂这一类药物或是这个“家族中”特定的分子所致。最近的TECOS试验回答了这个问题,试验在患有糖尿病和心血管疾病的14671病例中与常规治疗相比较,评估了西格列汀的非劣效以及加入西格列汀常规治疗后心血管长期的安全性(表1)(34)。平均3年的随访中,西他列汀组的主要发生事件为839例(11.4%),安慰剂组为851例(11.6%)。在心血管综合主要发生事件方面西他列汀组非劣于安慰剂组(风险比率0.98,95% 可信区域 0.88-1.09;P<0.001)。在这项试验中,就心衰住院率而言,意向治疗(ITT)分析显示了类似的结果(风险比率1,95% 可信区域 0.83-1.20;P = 0.98)。对比EXAMINE和SAVOR试验,TECOS试验中心衰相关事件发生结果和心血管死亡率是根据FDA的安全标准,在意向治疗人群中进行评定的。再次强调,这并没有显示任何糖尿病患者接受西他列汀治疗的额外风险(风险比率1.02,95% 可信区域0.90-1.15;P = 0.74)。此外,各种类型死亡率也在两组间进行了比较。值得注意的是,西他列汀与低血糖的重大风险无关(风险比率 1.12,95% 可信区域0.89-1.40)(34)。最近在欧洲心脏病学会(ESC)大会上提出,TECOS亚组的分析进一步强调了西他列汀对于心衰住院不会产生不利影响这一观点。TECOS试验最初的研究结果在今年早些时候的美国糖尿病协会被提出,为心衰基线控制所调整。根据ESC新闻稿,TECOS试验的新数据显示未调整和调整分析(也预先指定)具有相同的结果。(风险比率1,95% 可信区域0.84-1.20;和风险比率1.02,95% 可信区域 0.83-1.26)(35)。通过广泛的互补/敏感性分析,这些研究结果的稳定性得到了证实,均证明西他列汀的应用与心衰风险无关这一结论。 这样分析对于内分泌专家的影响是非常重要的,对于见到许多糖尿病和冠心病患者服用西他列汀糖治疗的心脏病专家也很重要。因此,即使有心衰病史,2糖尿病和心血者管患者也能够安全使用抗高血糖药物西他列汀而无需考虑心血管并发症。这些令人鼓舞的数据坚定地证明了心衰风险增加不是使用DPP-4抑制剂这一类药物产生的影响。这一假设结果由观测的研究结果所加强证实,研究显示DPP-4抑制剂对于心衰相关风险事件结局的中立甚至有益的影响(36,37)。然而,在安全方面需要进一步研究得出可靠结论,证明在糖尿病和心血管疾病的患者中应用沙格列汀和阿格列汀的安全性。
开放性讨论
就心衰风险而言,与其他降糖药物相比较,一个重要的临床问题是解答DPP-4抑制剂如何发挥药效。最近的一项回顾性研究,包含从18000000个人中抽取出127555非2型糖尿病个体,研究报道了使用噻唑烷二酮类药物,或单独使用磺脲类药物或联合二甲双胍患者的相关数据(38)。将测得的混杂因素调整后,在平均随访2.6年的随访中,与磺脲类药物相比,DPP-4抑制剂应用使心衰住院风险降低(风险比率 0.78,95% C可信区域0.62-0.97;P = 0.026)。有趣的是,DPP-4I后依然倾向匹配与心衰住院风险降低相关(HR 0.70,95% CI 0.52-0.94;P = 0.018)。有趣的是,在倾向匹配后DPP-4抑制剂依然表现为心衰住院风险降低。(风险比率0.70,95% 可信区域 0.52-0.94;P = 0.018)DPP-4抑制剂使用产生的28%-30%的心衰住院低风险,可能来自于DPP-4抑制剂有益的保护作用或磺脲类药物对心衰的有害影响。事实上,与二甲双胍相比,磺脲类药物与心衰风险增加相关(39)。总的来说,研究者得到这些结果并不是想证明DPP-4抑制剂与磺脲类明确的利弊比较,而是想提供一个广泛的,有见地的简要概述,关于以口为基础的不同抗糖尿病药物应用将如何影响心衰风险。毫无疑问,进一步的研究是必要的,从而进一步评估不同的降糖药物对个体心衰相关风险事件结果的影响。
另一方面,值得注意的是,确认2型糖尿病患者在临床实践中接受治DPP-4抑制剂的治疗。最近的EMPA-REG试验证明这一点特别重要,试验表明在患有心血管疾病的2型糖尿病患者中,钠-葡萄糖协同转运蛋白2抑制剂(SGLT2)可降低14%心血管疾病死亡的主要终点事件,非致死性心肌梗死和非致命性中风(风险比率 0.86,95% 可信区域0.74-0.99),可降低38%的心血管死亡率(风险比率0.62,95% 可信区域 0.49-0.77)以及降低35%的心衰住院率(风险比率0.65,95% 可信区域0.50-0.85)(40)。这是首次一个糖尿病试验清楚地表明,降血糖药物即SGLT2抑制剂Empagliflozin可能深刻地影响2型糖尿病患者的已患有的心血管并发症病史。SGLT2抑制剂通过抑制肾脏对葡萄糖重吸收和分泌,从而降低血浆葡萄糖浓度(41)。据报道,作为单一疗法或附加的治疗,这些药物可降低2型糖尿病患者,甚至慢性肾脏病2期或3期患者的糖化血红蛋白水平。 然而,糖尿病是一种复杂的疾病,涉及多个代谢缺陷及其治疗往往需要联合用药,最终使糖化血红蛋白水平显著降低(42)。在过去的几年中,几个血糖控制的随机试验研究了DPP-4抑制剂和SGLT2抑制剂的联合应用是否将产生额外的益处。使用这种组合的基本原理是基于SGLT2诱导糖尿引起代偿性内源性胰高血糖素水平增加,抵消了其约50%降血糖作用效果。另一方面,DPP-4抑制剂能抑制胰高血糖素分泌从而减弱内源性激素的产生。然而,这样的协同作用只有部分证明DPP-4抑制剂和SGLT2抑制剂在2型糖尿病患中联合应用治疗的效果(43)。最近由Rosenstock博士等人的研究中,534名二甲双胍治疗后血糖控制不佳的患者,随机接受单用Dapagliflozin,单用沙格列汀,或联合应用沙格列汀与Dapagliflozin超过24周的时间(44)。沙格列汀和Dapagliflozin可分别降低0.88%和1.2%的糖化血红蛋白水平,而结合应用降低了1.47%,这显著低于这种方法所预期达到的效果(43)。最近的另一项研究与其结果一致,表明结合Empagliflozin 和利拉利汀应用降低糖化血红蛋白效果优于作为二甲双胍附加治疗的单独使用Empagliflozin或利拉利汀的效果,即使此优势并不显著(45)。总的来说,这些研究结果表明即使机体能很好地耐受DPP-4抑制剂和SGLT2抑制剂的联合应用,其总体益处是相当小的,并且此方法的成本可能引起关注。换句话说,了解2型糖尿病患者应用DPP-4抑制剂进行降血糖治疗的同时服用Empagliflozin是否安全是重要的。这特别适用于那些伴有心衰以及长期处于心衰并发症的高危患者。
Acknowledgements
None.
Footnote
Conflicts of Interest: The author has no conflicts of interest to declare.
参考文献
- Nichols GA, Gullion CM, Koro CE, et al. The incidence of congestive heart failure in type 2 diabetes: an update. Diabetes Care 2004;27:1879-84. [PubMed]
- Lüscher TF. Risk factors for and management of heart failure. Eur Heart J 2015;36:2267-9. [PubMed]
- Kannel WB, McGee DL. Diabetes and cardiovascular disease. The Framingham study. JAMA 1979;241:2035-8. [PubMed]
- Nieminen MS, Brutsaert D, Dickstein K, et al. EuroHeart Failure Survey II (EHFS II): a survey on hospitalized acute heart failure patients: description of population. Eur Heart J 2006;27:2725-36. [PubMed]
- Dei Cas A, Khan SS, Butler J, et al. Impact of diabetes on epidemiology, treatment, and outcomes of patients with heart failure. JACC Heart Fail 2015;3:136-45. [PubMed]
- Lüscher TF. Heart failure and comorbidities: renal failure, diabetes, atrial fibrillation, and inflammation. Eur Heart J 2015;36:1415-7. [PubMed]
- Rydén L, Armstrong PW, Cleland JG, et al. Efficacy and safety of high-dose lisinopril in chronic heart failure patients at high cardiovascular risk, including those with diabetes mellitus. Results from the ATLAS trial. Eur Heart J 2000;21:1967-78. [PubMed]
- Boudina S, Abel ED. Diabetic cardiomyopathy revisited. Circulation 2007;115:3213-23. [PubMed]
- MacDonald MR, Petrie MC, Varyani F, et al. Impact of diabetes on outcomes in patients with low and preserved ejection fraction heart failure: an analysis of the Candesartan in Heart failure: Assessment of Reduction in Mortality and morbidity (CHARM) programme. Eur Heart J 2008;29:1377-85. [PubMed]
- Owan TE, Hodge DO, Herges RM, et al. Trends in prevalence and outcome of heart failure with preserved ejection fraction. N Engl J Med 2006;355:251-9. [PubMed]
- Aguilar D, Deswal A, Ramasubbu K, et al. Comparison of patients with heart failure and preserved left ventricular ejection fraction among those with versus without diabetes mellitus. Am J Cardiol 2010;105:373-7. [PubMed]
- Stratton IM, Adler AI, Neil HA, et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. BMJ 2000;321:405-12. [PubMed]
- Gilbert RE, Krum H. Heart failure in diabetes: effects of anti-hyperglycaemic drug therapy. Lancet 2015;385:2107-17. [PubMed]
- Castagno D, Baird-Gunning J, Jhund PS, et al. Intensive glycemic control has no impact on the risk of heart failure in type 2 diabetic patients: evidence from a 37,229 patient meta-analysis. Am Heart J 2011;162:938-48.e2.
- Iribarren C, Karter AJ, Go AS, et al. Glycemic control and heart failure among adult patients with diabetes. Circulation 2001;103:2668-73. [PubMed]
- Thrainsdottir IS, Aspelund T, Hardarson T, et al. Glucose abnormalities and heart failure predict poor prognosis in the population-based Reykjavik Study. Eur J Cardiovasc Prev Rehabil 2005;12:465-71. [PubMed]
- Held C, Gerstein HC, Yusuf S, et al. Glucose levels predict hospitalization for congestive heart failure in patients at high cardiovascular risk. Circulation 2007;115:1371-5. [PubMed]
- Ferrannini E, DeFronzo RA. Impact of glucose-lowering drugs on cardiovascular disease in type 2 diabetes. Eur Heart J 2015;36:2288-96. [PubMed]
- ORIGIN Trial Investigators. Basal insulin and cardiovascular and other outcomes in dysglycemia. N Engl J Med 2012;367:319-28. [PubMed]
- Standl E, Erbach M, Schnell O. Dipeptidyl-peptidase-4 Inhibitors and Heart Failure: Class Effect, Substance-Specific Effect, or Chance Effect? Curr Treat Options Cardiovasc Med 2014;16:353. [PubMed]
- Zhong J, Goud A, Rajagopalan S. Glycemia Lowering and Risk for Heart Failure: Recent Evidence from Studies of Dipeptidyl Peptidase Inhibition. Circ Heart Fail 2015;8:819-25. [PubMed]
- Zhong J, Maiseyeu A, Davis SN, et al. DPP4 in cardiometabolic disease: recent insights from the laboratory and clinical trials of DPP4 inhibition. Circ Res 2015;116:1491-504. [PubMed]
- Sauvé M, Ban K, Momen MA, et al. Genetic deletion or pharmacological inhibition of dipeptidyl peptidase-4 improves cardiovascular outcomes after myocardial infarction in mice. Diabetes 2010;59:1063-73. [PubMed]
- Connelly KA, Zhang Y, Advani A, et al. DPP-4 inhibition attenuates cardiac dysfunction and adverse remodeling following myocardial infarction in rats with experimental diabetes. Cardiovasc Ther 2013;31:259-67. [PubMed]
- Read PA, Khan FZ, Heck PM, et al. DPP-4 inhibition by sitagliptin improves the myocardial response to dobutamine stress and mitigates stunning in a pilot study of patients with coronary artery disease. Circ Cardiovasc Imaging 2010;3:195-201. [PubMed]
- Scirica BM, Bhatt DL, Braunwald E, et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med 2013;369:1317-26. [PubMed]
- White WB, Cannon CP, Heller SR, et al. Alogliptin after acute coronary syndrome in patients with type 2 diabetes. N Engl J Med 2013;369:1327-35. [PubMed]
- Sanon VP, Sanon S, Pham SV, et al. Play of Chance Versus Concerns Regarding Dipeptidyl Peptidase-4 Inhibitors: Heart Failure and Diabetes. Clin Diabetes 2014;32:121-6. [PubMed]
- Rajagopalan R, Rosenson RS, Fernandes AW, et al. Association between congestive heart failure and hospitalization in patients with type 2 diabetes mellitus receiving treatment with insulin or pioglitazone: a retrospective data analysis. Clin Ther 2004;26:1400-10. [PubMed]
- Zannad F, Cannon CP, Cushman WC, et al. Heart failure and mortality outcomes in patients with type 2 diabetes taking alogliptin versus placebo in EXAMINE: a multicentre, randomised, double-blind trial. Lancet 2015;385:2067-76. [PubMed]
- Standl E, Schnell O. DPP-4 inhibitors and risk of heart failure EXAMINEd. Lancet 2015;385:2022-4. [PubMed]
- Udell JA, Cavender MA, Bhatt DL, et al. Glucose-lowering drugs or strategies and cardiovascular outcomes in patients with or at risk for type 2 diabetes: a meta-analysis of randomised controlled trials. Lancet Diabetes Endocrinol 2015;3:356-66. [PubMed]
- Marney A, Kunchakarra S, Byrne L, et al. Interactive hemodynamic effects of dipeptidyl peptidase-IV inhibition and angiotensin-converting enzyme inhibition in humans. Hypertension 2010;56:728-33. [PubMed]
- Green JB, Bethel MA, Armstrong PW, et al. Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2015;373:232-42. [PubMed]
- Available online: http://www.escardio.org/The-ESC/Press-Office/Press-releases/Last-5-years/new-tecos-analysis-adds-heart-failure-data-for-sitagliptin
- Gejl M, Starup-Linde J, Scheel-Thomsen J, et al. Risk of cardiovascular disease: the effects of diabetes and anti-diabetic drugs - a nested case-control study. Int J Cardiol 2015;178:292-6. [PubMed]
- Velez M, Peterson EL, Wells K, et al. Association of antidiabetic medications targeting the glucagon-like peptide 1 pathway and heart failure events in patients with diabetes. J Card Fail 2015;21:2-8. [PubMed]
- Fadini GP, Avogaro A, Degli Esposti L, et al. Risk of hospitalization for heart failure in patients with type 2 diabetes newly treated with DPP-4 inhibitors or other oral glucose-lowering medications: a retrospective registry study on 127,555 patients from the Nationwide OsMed Health-DB Database. Eur Eur Heart J 2015;36:2454-62. [PubMed]
- Tzoulaki I, Molokhia M, Curcin V, et al. Risk of cardiovascular disease and all cause mortality among patients with type 2 diabetes prescribed oral antidiabetes drugs: retrospective cohort study using UK general practice research database. BMJ 2009;339:b4731. [PubMed]
- Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015. [Epub ahead of print]. [PubMed]
- Gallo LA, Wright EM, Vallon V. Probing SGLT2 as a therapeutic target for diabetes: basic physiology and consequences. Diab Vasc Dis Res 2015;12:78-89. [PubMed]
- Inzucchi SE, Bergenstal RM, Buse JB, et al. Management of hyperglycaemia in type 2 diabetes: a patient-centered approach. Position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2012;55:1577-96. [PubMed]
- Abdul-Ghani M. Where does combination therapy with an SGLT2 inhibitor plus a DPP-4 inhibitor fit in the management of type 2 diabetes? Diabetes Care 2015;38:373-5. [PubMed]
- Rosenstock J, Hansen L, Zee P, et al. Dual add-on therapy in type 2 diabetes poorly controlled with metformin monotherapy: a randomized double-blind trial of saxagliptin plus dapagliflozin addition versus single addition of saxagliptin or dapagliflozin to metformin. Diabetes Care 2015;38:376-83. [PubMed]
- DeFronzo RA, Lewin A, Patel S, et al. Combination of empagliflozin and linagliptin as second-line therapy in subjects with type 2 diabetes inadequately controlled on metformin. Diabetes Care 2015;38:384-93. [PubMed]
特别感谢译者:刘越 王莹 哈尔滨医科大学附属第一医院心内科


