CABG术后短时房颤预示短期和长期不良事件
引言
AF是CABG术后最常见的并发症,影响着16-30%术后期的患者(1,2)。术后房颤(Post-operative AF,POAF)会延长住院时间,再入ICU(Intensive care unit)几率增加,并导致充血性心力衰竭、脑卒中以及医疗保健资源利用的增加(2-7)。通过术前危险因素的鉴别,临床预测模型以及预防性策略来减少这种常见并发症的发病率与死亡率仍处于优先地位(8-12)。
CABG后第一年AF的发生在小于70岁患者中更为常见,这与肾功能不全与感染比率(13)以及入院率与短期死亡率增加密切相关(14)。POAF的出现确实使患者发病和死亡的风险增加,即使他们出院时是窦性心律。关于房颤是否与术后反复发生房性心律失常的实质性比率(39%)有关联(15)目前尚不得知。
我们探究以确定:1、与TPOAF相关的长期后果 2、在此种情况下针对患者采取的常见医疗措施的效果。
研究方法
研究设计与患者群体
克利夫兰诊所心血管信息注册表包含预期收集的每年前一千名进行开放式心脏手术的患者的临床与实验室数据,并保持完善30天、60天、90天以及1年的随访信息。这个数据库被用来连续记录5205名在1993年1月到2005年12月之间第一次经历离体CABG手术的患者,这些患者都无在案的房颤既往史。一共有1560名患者被认定并发POAF(定义为AF持续时间≥2mins且<7days),其中70名出院时已发展为持续性房颤而排除于分析之外。将剩下的出院时并未发展为持续性房颤,诊断并发TPOAF的患者(n=1490,29%)与那些未并发POAF的患者(n=3645)作比较。同意参加的人员年龄必须超过18岁并要符合标准。如果患者具有以下情况将被排除:术前诊断有慢性或阵发性房颤,出血体质,高凝状态,任何需要慢性抗凝物如华法林,进行冠状动脉搭桥联合瓣膜置换术或Cox迷宫手术,或者确认之前有过开放式心脏手术。另外,患者如已知既往患有或术前超声心动图符合严重的瓣膜疾病也被排除。所有手术都由有着丰富经验的心胸外科医生在大型三级转诊教育中心,应用最标准的搭桥技术谨慎进行。在手术后最开始的时期,所有患者都被安置在外科ICU持续监测,直到他们临床上适宜转入心脏或心胸外科低一级的混合病房。重要的临床和实验室数据有望同时收集手术前和手术后时期的信息。出院后随访信息通过官方人员上访和电话采访获得。出院后开处的药物,包括他汀类、β-受体阻断剂、血管紧张素转换酶抑制剂、阿司匹林、华法林、胺碘酮和钙通道阻滞剂同样记录在数据库中。此项研究被机构审查委员会(the institutional review board ,IRB)批准并作为正在进行的CVIR研究小组的一部分。
实验终点
实验将患者分为诊断有TPOAF和未有POAF两组,比较两组各自总体死亡的终点、MI和脑卒中情况,同时评估几类常见的出院药物对其造成的影响。数据预期收集每个病人住院期间和30天、6个月以及每年直至第五年的情况,以此作为实验终点。出院后随访日期的中位数是1880天。
定义
患者若通过床边监测或12导联心电图(EKG)记录发作过室上性心动过速抑或经医师认证发生AF或扑动,则他们被视为发展为POAF。TPOAF是指那些已被记录发展了POAF,EKG显示AF但没有出院回家的患者。死亡定义为所有原因的死亡并且需要社会保障死亡指数(SSDI)或者家庭电话采访来确认。脑卒中定义为一种新出的、急性的持续时间超过24小时的局灶性脑神经功能缺陷,是由脑局部缺血或者颅内出血引起,而且要被标准图像形态支持匹配,如核磁共振影像、计算机X线断层扫描、跨颅多普勒。若具有以下一种或几种情况则定义为MI:在十二导联EKG上连续两个导联新出现“q”波,典型的心脏生物标记物的升降(或手术后出院之前生物标记物升高超过五倍正常上限)伴有临床表现,或单光子发射计算机断层扫描、正电子发射计算机断层扫描、跨胸超声心动图提示心肌疤痕形成。
数据分析
对连续变量和分类变量进行描述性统计以总结基线临床与实验室数据特征,包括出院用药简介。通过对分类变量的卡方检验与菲舍尔精确检验和对连续变量的学生t检验与Wilcoxon秩和检验来分析组别之间的差别。长期死亡率的预测值最初分别被估算出来,然后再通过多变量比例风险模型确认。Kaplan-Meier曲线用来描绘组别之间生存率的差异。
倾向评分(Propensity score,PS)分析是通过应用nonparsimonious逻辑回归模型来调整基线数据,这项分析包含有以下相关变量:年龄,性别,种族,高血压病史,糖尿病,烟草使用情况,MI,室性心动过速,外周动脉疾病,颈动脉疾病,COPD,肾功能不全,CCS分级,NYHA分级和射血分数。
根据发展POAF的可能性对患者进行0-1打分,然后PS作为一个共同变量加入到后续的比例风险模型,并为队列进行倾向匹配。逻辑回归模型的C-统计为0.79。多变量Cox比例风险方法(逐步回归)用来描述与死亡率独立相关的变量。多变量Cox比例风险模型用来对出院摄生法的不稳定基线进行控制,包括应用β-受体阻断剂、他汀类药物、阿司匹林、ACEI、华法林、抗心律失常药和胺碘酮。所有分析都是双尾的,并且其统计学意义的限制性通过P值<0.05来界定。所有数据分析都在SAS 8.2版上进行。
研究结果
基线特征
患者有无TPOAF的基线特征的比较见表1。5205名患者中共有1490名(29%)列入最终分析中并被记录为发展了TPOAF。关于性别和糖尿病、冠心病(coronary artery disease,CAD)、MI和肾疾病的既往史,组别之间是相似的。与没有发展POAF的患者相比,具有TPOAF的患者通常年龄更大,白人居多,同时具有高血压,并且更有可能有PAD、COPD和颈动脉疾病的既往史。
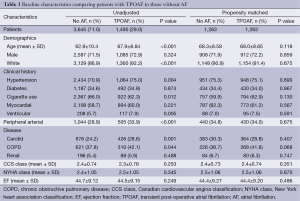
Full table
出院药物
组别的出院用药情况见表2。组别之间的出院药物处方模式是不同的,这是因为患有TPOAF的患者在统计学上更需要服用华法林、胺碘酮或者其他抗心律失常治疗。
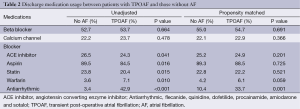
Full table
住院临床结果
表3包含了未调整的死亡、MI和脑卒中的比率。尽管住院死亡数很少(总共七个),但患有TPOAF的患者与没有POAF相比,未调整的住院死亡率显著较高(0.4% vs. 0%;P<0.001)。组别间未见报道有住院脑卒中或术后MIs发生。
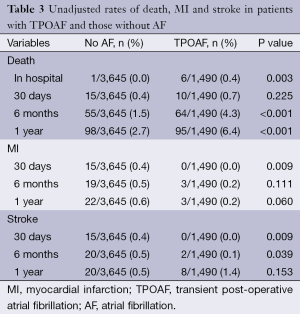
Full table
一年临床结果
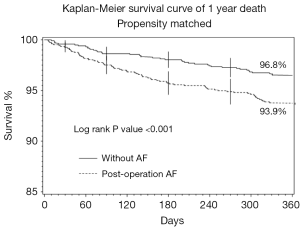
总体一年死亡、MI、脑卒中的比率分别为3.7%、0.8%、2.6%。与未并发房颤的患者相比,发生TPOAF的患者一年死亡数明显增加(6.4% vs. 2.7%; P<0.001)。图1 Kaplan-Meier曲线描绘了组别间一年的总体死亡率。但是一年的随访中不同组MI或脑卒中的发生率无显著差别(分别为0.2% vs. 0.6%;P=0.060 与0.5% vs. 1.4%;P=0.153)。
多因素分析
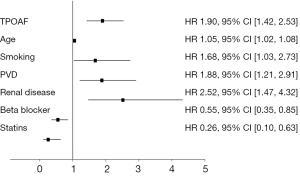
多因素分析的结果见图2。经过对基线不稳定进行控制后,多因素分析提示TPOAF可作为所有原因致死的独立预测因子(HR 1.89,95% CI,1.42-2.53;P<0.001),其他死亡预测因素包括年龄、周围血管疾病、肾功能不全或先前有烟草滥用。他汀类药物和β-受体阻滞剂的应用疗法与一年死亡数的减少独立相关,然而,阿司匹林、华法林或胺碘酮并未显著影响总体死亡率。
倾向分析
1263名患者依据是否有TPOAF匹配的队列稍后会分析。经过倾向匹配,不同组之间在年龄、种族、以及高血压、周围血管疾病、室性心律失常或COPD既往史上面无显著差别。在倾向匹配队列,TPOAF组相比无AF组,一年死亡率显著增高(6.1% vs. 3.2%;P<0.001)。多因素分析倾向匹配队列的结果提示年龄、烟草使用情况和肾疾病都是死亡的预测因素。
经过进行PS分析,出院药物的差别仍然显示TPOAF组的患者更可能接受抗心律失常治疗,而且组别之间使用华法林治疗无显著趋势(表2)。
研究讨论
目前已确定CABG术后POAF与早期死亡率增高密切相关,POAF患者术后血液动力学不稳定风险增高,需要延长机械通气时间,增多重插管与升压药使用几率,在花费巨大的ICU留置的时间也增加(2,4-6,16)。术后30天随着脑栓塞几率增加,复发性或持续性心律失常致频繁再入院,出院后6个月内总体死亡率也可能增加,POAF的死亡率被记录扩展超过住院指数(1,6,15)。特别是,针对这项课题的绝大多数先前工作都集中于总体的住院或短期结果,由于患者个数小,随访数据不完整,在很多病例中还包含有异构手术的人群,使研究结果很受限制。所以,就TPOAF的影响以及长期发病率和首次患者的死亡率诊治方面,纯真性CABG手术尚不清楚。
研究的主要结果显示接受了第一次离体CABG手术的患者,在术后普遍并发TPOAF(29%),TPOAF是所有原因中短期和长期致死的强烈、独立预测因子。此外,在术后使用他汀类药物和β-受体阻滞剂与1年间整个队列的死亡率下降有关,而常用来治疗POAF的例如阿司匹林、华法林和胺碘酮等药物则没有明显影响整体的死亡率。此前有研究人数较少、随访时间较短的研究表明POAF与高住院率和高短期死亡率有关(5,13),此前研究支持本次研究的结果。本次研究结果也支持其他研究得出的POAF与长期死亡率有关的结论(14)。
至于是哪种TPOAF使死亡风险增加及其确切机理并不可从我们的数据中获得,正如通常情况下,受TPOAF折磨的患者的共病基线更高,导致他们副作用风险更高。然而,即使TPOAF与经过对混杂变量调整仍保持的死亡率有显著联系,但仍可得可观察到的死亡率似乎不是基线风险的差别的结果。也许TPOAF并不直接导致可观察到的死亡率增加,而是一种偶发情况(7,14)。在这种理论下,TPOAF与死亡之间并无因果关系,而仅仅是对敏感亚人群的一种标记,受所有原因致死的死亡率显著增高的影响。
我们发现术后服用他汀类药物和β-受体阻断剂与一年死亡率降低独立相关,这项发现支持了某种理论,即出院药物服用的关键不同能显著影响总体的长期后果,至于是哪种β-受体阻断剂或他汀类药物有这种好处及其机理仍不清楚。积累的身体数据提示AF—尤其是短时或阵发性AF—可能是一种炎症介导的过程(8,17-19)而且最近的工作提示他汀类药物的抗炎特性可以减少TPOAF的发病率(12,20-22),故术后应用他汀类药物以推迟或终止反复发作的TPOAF及伴随的发病率是有一定道理的。同样地,β-受体阻断剂已长期应用于手术期间,对控制室性和房性为主的心律失常很有效果,而且可降低心肌耗氧量,减少缺血负担(11)。此外,几项有里程碑意义的试验都证明,手术期间应用β-受体阻断剂有助于在术后长达6个月内实质性减少心血管事件发生率和总体改善状况(23,24)。同时大量研究提示手术期间应用β-受体阻断剂在预防POAF上是有效的,但缺少有关这些因子的术后功效的数据。术后AF患者很可能交感神经张力提高,和那些之前意识到的相比,总体可能通过术后应用β-受体阻断剂实质性获得更多和更持久的益处。
TPOAF并不引起脑卒中(一种AF的预期结果)的发生率增加,这一点是值得注意的。这个发现和以往研究存在冲突,之前工作提示POAF与早期或住院脑卒中显著相关,尤其在低心输出量情况下(14,25,26)。但是,这些研究几乎都独对术后早期(<10days)限制。我们的数据证实只有其他研究估计POAF与脑卒中的长期联系,我们发现术后直到1年POAF与脑卒中都无联系(13)。这个发现可能是由于预先在POAF组内使用了抗心律失常药和抗凝血剂联合疗法,使得窦性心律保持的几率更高,心源性卒中发生更少。在当前研究,和无POAF相比,TPOAF患者(29%)确实出院时明显更可能需要一些不同形式的抗心律失常疗法,这是否可提示TPOAF出现复发的可能性低并且发生脑栓塞的风险低,还是说就像之前提示的那样,TPOAF只是一个对非心血管死亡敏感的亚人群的标记,目前还不知道。而且,尽管之前有报道过患者出院用抗心律失常疗法可能对生存有益,但是我们的多因素分析却不能显示用抗心律失常药或华法林对生存有任何好处 (14)。
研究局限
目前这个研究有几个局限的地方。首先,数据受任何单中心、回顾性、观察性研究的固有局限性所影响;其次,我们不能保证所有患者都能顺从,也没有对患者出院药物摄生法包含的各类因素做出改变。所以,我们的数据很有可能高估或低估了任何治疗效果。而且,考虑到长期随访的性质以及这个数据库中含有的如此之大的参考人群,技术上并不可客观评价患者复发AF。此外,由于随访通过电话方式以及尸检资料的匮乏,我们不能确定死亡具体原因与TPOAF有关。我们确实观察到绝大多数POAF患者只短时出现过—其中只有70名患者(1.3%)出院时有持续性房颤。我们认为这是因为在术后治疗中出现绝大多数患者表现出TPOAF并且没有预先工作对这种特定亚群组的结局或者治疗策略进行报道。
研究结论
当前研究得出第一次离体CABG手术并发TPOAF可能是一个对所有原因长期死亡的独立预测因素,我们的研究还提示联合应用他汀类药物和β-受体阻滞剂可显著降低这个风险,但常规使用抗心律失常药和抗凝血药并不能显著影响总体死亡率。这些结果为围手术期外他汀类药物和β-受体阻滞剂的益处提供证据,也提示发展了TPOAF的一组人群具有死亡高风险,不仅在立即或短期内,还是住院指数后延长的一段时期。通过适当有力的随机临床试验,这些数据值得预期的验证。
声明
作者特别感谢 Peter Zimbwa博士、Stephen Chen博士和Ryan Daly博士协助数据收集工作。
披露: 作者宣称没有利益冲突。
References
- Lauer MS, Eagle KA, Buckley MJ, et al. Atrial fibrillation following coronary artery bypass surgery. Prog Cardiovasc Dis 1989;31:367-78. [PubMed]
- Mathew JP, Parks R, Savino JS, et al. Atrial fibrillation following coronary artery bypass graft surgery: predictors, outcomes, and resource utilization. MultiCenter Study of Perioperative Ischemia Research Group. JAMA 1996;276:300-6. [PubMed]
- Ferguson TB Jr, Hammill BG, Peterson ED, et al. A decade of change--risk profiles and outcomes for isolated coronary artery bypass grafting procedures, 1990-1999: a report from the STS National Database Committee and the Duke Clinical Research Institute. Society of Thoracic Surgeons. Ann Thorac Surg 2002;73:480-9; discussion 489-90. [PubMed]
- Creswell LL, Schuessler RB, Rosenbloom M, et al. Hazards of postoperative atrial arrhythmias. Ann Thorac Surg 1993;56:539-49. [PubMed]
- Almassi GH, Schowalter T, Nicolosi AC, et al. Atrial fibrillation after cardiac surgery: a major morbid event? Ann Surg 1997;226:501-11; discussion 511-3. [PubMed]
- Tamis JE, Steinberg JS. Atrial fibrillation independently prolongs hospital stay after coronary artery bypass surgery. Clin Cardiol 2000;23:155-9. [PubMed]
- Hogue CW Jr, Creswell LL, Gutterman DD, et al. Epidemiology, mechanisms, and risks: American College of Chest Physicians guidelines for the prevention and management of postoperative atrial fibrillation after cardiac surgery. Chest 2005;128:9S-16S. [PubMed]
- Halonen J, Halonen P, Järvinen O, et al. Corticosteroids for the prevention of atrial fibrillation after cardiac surgery: a randomized controlled trial. JAMA 2007;297:1562-7. [PubMed]
- White CM, Caron MF, Kalus JS, et al. Intravenous plus oral amiodarone, atrial septal pacing, or both strategies to prevent post-cardiothoracic surgery atrial fibrillation: the Atrial Fibrillation Suppression Trial II (AFIST II). Circulation 2003;108 Suppl 1:II200-6. [PubMed]
- Fortescue EB, Kahn K, Bates DW. Development and validation of a clinical prediction rule for major adverse outcomes in coronary bypass grafting. Am J Cardiol 2001;88:1251-8. [PubMed]
- Halonen J, Hakala T, Auvinen T, et al. Intravenous administration of metoprolol is more effective than oral administration in the prevention of atrial fibrillation after cardiac surgery. Circulation 2006;114:I1-4. [PubMed]
- Patti G, Chello M, Candura D, et al. Randomized trial of atorvastatin for reduction of postoperative atrial fibrillation in patients undergoing cardiac surgery: results of the ARMYDA-3 (Atorvastatin for Reduction of MYocardial Dysrhythmia After cardiac surgery) study. Circulation 2006;114:1455-61. [PubMed]
- Elahi M, Hadjinikolaou L, Galiñanes M. Incidence and clinical consequences of atrial fibrillation within 1 year of first-time isolated coronary bypass surgery. Circulation 2003;108 Suppl 1:II207-12. [PubMed]
- Villareal RP, Hariharan R, Liu BC, et al. Postoperative atrial fibrillation and mortality after coronary artery bypass surgery. J Am Coll Cardiol 2004;43:742-8. [PubMed]
- Loubani M, Hickey MS, Spyt TJ, et al. Residual atrial fibrillation and clinical consequences following postoperative supraventricular arrhythmias. Int J Cardiol 2000;74:125-32. [PubMed]
- Aranki SF, Shaw DP, Adams DH, et al. Predictors of atrial fibrillation after coronary artery surgery. Current trends and impact on hospital resources. Circulation 1996;94:390-7. [PubMed]
- Boos CJ, Anderson RA, Lip GY. Is atrial fibrillation an inflammatory disorder? Eur Heart J 2006;27:136-49. [PubMed]
- Engelmann MD, Svendsen JH. Inflammation in the genesis and perpetuation of atrial fibrillation. Eur Heart J 2005;26:2083-92. [PubMed]
- Chung MK, Martin DO, Sprecher D, et al. C-reactive protein elevation in patients with atrial arrhythmias: inflammatory mechanisms and persistence of atrial fibrillation. Circulation 2001;104:2886-91. [PubMed]
- Ramani G, Zahid M, Good CB, et al. Comparison of frequency of new-onset atrial fibrillation or flutter in patients on statins versus not on statins presenting with suspected acute coronary syndrome. Am J Cardiol 2007;100:404-5. [PubMed]
- Tveit A, Grundtvig M, Gundersen T, et al. Analysis of pravastatin to prevent recurrence of atrial fibrillation after electrical cardioversion. Am J Cardiol 2004;93:780-2. [PubMed]
- Shiroshita-Takeshita A, Schram G, Lavoie J, et al. Effect of simvastatin and antioxidant vitamins on atrial fibrillation promotion by atrial-tachycardia remodeling in dogs. Circulation 2004;110:2313-9. [PubMed]
- Mangano DT, Layug EL, Wallace A, et al. Effect of atenolol on mortality and cardiovascular morbidity after noncardiac surgery. Multicenter Study of Perioperative Ischemia Research Group. N Engl J Med 1996;335:1713-20. [PubMed]
- Poldermans D, Boersma E, Bax JJ, et al. The effect of bisoprolol on perioperative mortality and myocardial infarction in high-risk patients undergoing vascular surgery. Dutch Echocardiographic Cardiac Risk Evaluation Applying Stress Echocardiography Study Group. N Engl J Med 1999;341:1789-94. [PubMed]
- Hogue CW Jr, Murphy SF, Schechtman KB, et al. Risk factors for early or delayed stroke after cardiac surgery. Circulation 1999;100:642-7. [PubMed]
- Stamou SC, Hill PC, Dangas G, et al. Stroke after coronary artery bypass: incidence, predictors, and clinical outcome. Stroke 2001;32:1508-13. [PubMed]
特别感谢译者:赵一晨,本科就读于河北医科大学,现于河北省二院实习