人工瓣周漏的心脏影像
引言
人工瓣周漏(PVL)是一种外科换瓣术后严重的并发症,往往由于人工瓣环与原心脏组织的密闭性不好从而造成人工瓣瓣周的返流。虽然大部分此类病人都是偶然发现存在轻度、无症状性的返流,仍有一小部分病人存在有明显临床表现的大量返流。
PVL的确切发病率尚不明确,各个注册中心之间存在较大差异。PVLs在机械瓣部位,特别是二尖瓣的位置更为常见。二尖瓣周漏(PVMLs)大约占所有病例的7-17%,主动脉瓣周漏(PVALs)约占2-10%(1,2)。
对有症状的PVLs,外科手术是传统的治疗方式。然而,经皮导管关闭术正逐渐兴起,对于部分病人来说,是一种新型的微创且疗效更好的治疗方式。
在最初的诊断、确定选择合适的病人进行经导管介入治疗以及术中的监护中,超声心动图发挥了重要的作用。
PVLs的诊断
PVLs的临床表现取决于返流的严重程度,轻度、无血流动力学意义的PVLs病人可无症状,而存在大量、偶尔的严重PVLs病人则会出现充血性心力衰竭(HF)和溶血性贫血的症状。
严重的PVLs通常在二尖瓣比主动脉处更为常见,而在肺动脉瓣和三尖瓣处鲜有发生(3)。
早期诊断具有一定挑战性。最初的可疑体征是在体检时发现的异常心脏杂音,通常很柔和而难以闻及,另外还有在血液化验时发现的明显的溶血证据(4)。
虽然超声心动图是确诊和量化PVL的首选检查方式,但其他影像检查如计算机断层扫描(CT)或心脏磁共振(CMR)也能进一步提供相关有用的信息以辅助诊断。
超声心动图
超声心动图是诊断、评估瓣膜返流程度的金标准。
最先阶段通常采用的是经胸超声心动图(TTE)。虽然TTE能通过彩色多普勒确定返流束,然而由于人工瓣膜的存在而产生的假性声束则会掩盖病情的严重程度甚至反流束。对于临床有疑似PVL的病人,必须进行经食道超声心动图(TEE)的评估后明确诊断。
近年来,与二维(2D)超声心动图相比,三维(3D)TEE在对瓣周漏的评估,特别是在对多发性缺损病人的评估方面显示了更高的精确性(5)。在测定大小、形状方面的优势使后者成为评估PVL的金标准。对于确认测量到的面积与实际缺损是否一致以及可能的假性声束不被误认为缺损口的一部分,彩色血流多普勒或许非常实用。
由于特殊的PVLs的复杂性以及超声心动图对一些特殊情况(声影、异常的射流)的局限性,PVL的评估尚需要其他影像技术的支持才能完成。
其他影像技术
ECG门控CT与三维或四维重建的联合技术对PVLs的评估具有一定前景。有了螺旋CT连续性结果和四维重建的回放性ECG门控重建技术,可以很仔细地观察到PVLs的细节。进一步而言,在一些中心它能在经皮PVL关闭术操作过程中提供帮助(6)。
血管造影和CMR是作为补充的两种影像学检查手段。血管造影能对PVL进行定位并评估其大小,特别是在主动脉瓣的位置。其目前主要的挑战在于对瓣周漏的三维解剖及空间特征的界定。需要通过多个角度整合分析PVL的几何特征。例如,为了看清位于右侧Valsalva窦的主动脉PVLs,造影透视的角度就要取左前斜位,对于左冠窦则要取右前斜位,而无冠窦PVLs则采用侧位。对于二尖瓣PVLs,血管造影的作用就比较有限;但前位的PVLs可以在后前位加头位的角度,后间隔PVLs可以在右前位,侧位PVLs可以在侧位得到较好显示。心内科医生要记住对充血性心力衰竭的病人要避免过多的使用造影剂(7)。CMR能准确地进行血流成像和容量测量,特别是对于多处PVLs的病人有一定优势(8)。
在PVL的关闭术中,透视造影和心内的超声心动图提供了重要的信息。如前所述,透视造影使得二维的平面图像有了多角度投照而具有更大的移动、灵活性。特别是对于术中的监测,二维或三维的心内超声(ICE)提供了一种作为TEE的选择或补充性技术。它能提供更清晰的成像和更精细的定义。不像TEE,它不需要全身麻醉,这一点对于全身情况较差的病人而言是更好的选择,只需要局部麻醉(9)。
治疗
内科治疗
对症状性心衰的传统治疗首先是直接降低后负荷(10)。对于明确的有血流动力学意义的贫血病人,需要进行输血、注射红细胞生成素、补充铁和叶酸(11)。
外科手术
对于症状性的瓣周漏,外科手术已经成为传统的治疗首选。尽管围手术期高达约16%的死亡率,但在1、5、10年生存率上,再次治疗相较于内科治疗仍然显示出具有优势(12,13)。
根据引起瓣周漏的不同原因、瓣膜的条件或漏的位置,可以选择瓣周漏修补或者人工瓣膜置换(14)。包括二尖瓣漏的直接缝合、补片及正常全层自体组织修补的技术,都已经有过介绍(12)。
经皮介入治疗
目前经皮导管介入治疗正逐步兴起,作为一种微创的治疗方式,对于高危的病人,它可以降低外科手术较高的病死率。
首例采用这种治疗方式的报道在2003年,使用的是一种导管弹簧圈(15)。从此之后,各种装置(Rashkind封堵伞、Amplatzer封堵器、CardioSeal)应用于临床,如今各种新型的装置已经陆续应用于经皮瓣周漏封堵术(16)。
这些新兴技术的成功开展主要有赖于对缺损准确判断(位置、大小、瓣膜的解剖……)的能力,在这一点上三维TEE目前已经显示出其优越性。
PVL围手术期的评估
二尖瓣周漏
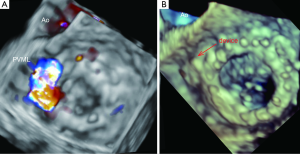
之前已经提到,TTE作为最初的影像手段,能够提供了心腔大小和功能、评估人工瓣膜功能的资料。三维经食道超声心动图(3D-TEE)是显示缺损及评估其空间特性最准确的检查方法,包括缺损的位置、大小以及封堵器的选择(图1)。
最初的TEE只是直接用来确认非正常的返流束或其他可疑的声像。对于瓣膜的检查,需要在人工二尖瓣的多个平面,从0°到180°进行扫查。
瓣周漏在超声的定义为缝合环之外区域回声的脱落,彩色多普勒可明确。PVLs用定性与定量超声的方法均可以进行评估。通常推荐使用联合参数的评估。对于固有的二尖瓣,可以采用返流束的面积和密度初步判断PVML的严重程度。虽然较大的等速表面积(PISA)壳提示严重的PVML,但这种PISA法作为定量评估PVML的方法尚不能被验证。由于顺行跨瓣血流会发生改变,对于人工瓣膜的多普勒定量评估方法仍不适宜(17)。
脉冲多普勒对于肺静脉类型的判断具有一定的帮助,收缩期的逆行血流是严重的二尖瓣返流的特异性征象(18)。
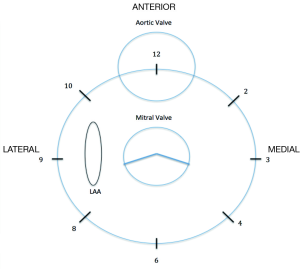
在对瓣膜的探查中,需要注意返流束从开始出现到消失之间的角度,以确定瓣周漏的程度。为了描述瓣周漏的位置及便于超声操作者和心内科介入医生的交流,必须使用心内标志性结构名称,如左心耳、主动脉瓣、十字交叉等(图2)(16)。通常三维图像模拟外科医生的视角,在主动脉瓣水平定义二尖瓣环的前叶为“12点钟”位置,而左心耳为“9点钟”位置。
通过三维TEE选择二尖瓣人工瓣膜的“面对面切面”有助于瓣周不连续的定位。三维TEE能够测量返流孔的侧面积,但是当该部位的不连续呈裂缝样的时候往往显示欠佳(19)。
主动脉瓣周漏
人工主动脉瓣的评估往往比二尖瓣难,这是由于主动脉瓣平面由于人工瓣的反射及声学阴影所致的干扰。
受人工瓣的反射和后侧瓣环的声学阴影的影响,主动脉瓣环的前侧是最棘手的检查位置。TEE也因此受限,这也意味着,虽然有三维TEE的评估,对位于前侧的PVL的评估检查显得较为困难(17)。
对主动脉瓣周返流的评估通常采用以下切面:食道中部长轴和短轴切面、纵向约100°-120°左侧弯曲的经胃切面及零度纵深经胃切面(17)。
冠状动脉的位置非常重要。对其进行评估需要特殊的切面:在主动脉窦水平的横切面即主动脉根部的短轴切面有利于判定左主干的开口;横切面0°-45°从瓣环到窦管连接可以扫查主动脉窦;主动脉根部长轴切面(120°)可以查看右冠状动脉(17)。
主动脉瓣返流严重程度的量化与固有瓣膜返流的标准类似:射流的宽度(收缩断面)、射流密度、射流减速率和舒张期降主动脉逆流的血流量。指南中推荐了一种半定量的评估方法,计算射流宽度和左室流出道(LVOT)直径百分比之间的关系:小于10%提示轻度返流;10%-20%中度而大于20%为重度。该方法由于血流加速方向和缺损的不规则形状而受到限制。收缩断面宽度可以评估返流开口面积(EROA)。这种方法的运用又由于瓣周射流辐射的范围和多个小射流的存在而受到限制(20)。射流宽度、射流密度、射流减速率和舒张期降主动脉逆流血流量都作为半定量评估射流严重程度的补充方法。当估测的AR在轻度以上时,就要考虑使用定量的参数如返流容积、返流分数等。
为了描述射流的位置,可以采用顺钟向定位的方法,这和二尖瓣处类似。例如,5点位置是左、右冠状窦交汇处,8点则是右冠窦和无冠窦的交汇处,而11点即是无冠窦和左冠窦的交汇处。主动脉的PVLs更多见于右冠窦和无冠窦交汇的尖端处(21)。
对于冠状动脉起源位置的确定,CTA可以作为三维TEE的替代方法。
PVL封堵术中监护的影像技术
二尖瓣周漏
经导管介入封堵术的过程时间较长并有一定的技术要求,所以通常使用全身麻醉。我们采用逆行或顺行方式进行手术。对于手术方式的选择取决于几个因素。一般来说,相对于逆行方式而言,顺行方式下导丝通过缺损口有较高的成功率,同时出血的危险性也相对较低。在PVLs的12和9点钟位置,顺行通过便于确定导丝位置。另一方面,逆行方式的路径最短,特别适用于6点钟位置、隔膜型或者不同位置多发的PVL(20)。
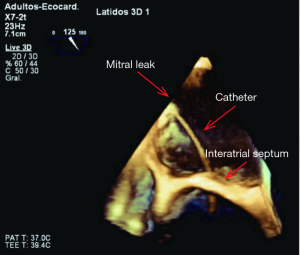
在手术过程中,实时三维TEE可以查看缺损的位置及周围结构关系。在继续手术之前心脏内的血栓必须予以清除。缩放的三维图像能识别解剖上的缺损,并帮助选择最合适的封堵器。三维TEE还可以帮助心脏介入医生引导导丝和导管穿过缺损口,并确保在封堵器释放之前导管有足够的位置(图3)。放置到正确的位置后,在超声心动图的引导下放置封堵器,随机可评估其位置是否合适(22)。
放置了封堵器后,三维TEE可对残余返流进行评估(图4)。如果仍存在有临床意义的返流,我们可以调整封堵器位置或者取出后使用不同大小的封堵器或多个封堵器的组合重新进行封堵。

封堵术中也可以采用其他影像技术如透视、二维TEE,特别是造影对比的运用,但随着三维TEE技术的不断发展,这些方法的使用逐渐减少。
CT透视图像融合成像是一种新型的技术,特别适用于经心尖路径。这种技术可以结合在术前获得的CT数据(胸廓内的结构:主动脉、冠状动脉、肋骨、人工二尖瓣)与实时透视来引导进行安全的穿刺(20)。
主动脉瓣周漏
主动脉周漏的介入常采用逆行经主动脉的方式进行。对于二尖瓣周漏,以三维TEE和透视为指导,以确保导丝位置的准确。对于主动脉瓣周漏的监测,ICE已经显示出具有一定优势及安全性。右心室流出道ICE成像可以提高位于前叶的瓣周漏的检出率,而这一点对于TEE采用前侧瓣环的声学阴影来判断而言经常成为挑战性难点。透视可以帮助确认瓣周漏的位置和大小。这些参数需要多个角度进行确定其几何特征。多数情况下,这些缺损都位于前侧,因此通常采用直角侧位切面和右前斜位,从而与人工瓣膜成直角的角度。
在释放封堵器的过程中,超声心动图发挥了重要的作用,特别是能确保瓣下结构的正常功能并排除冠状动脉口的阻塞。
若在逆行经主动脉方式未能成功封堵,我们应该考虑经心尖途径的方法选择人工二尖瓣和三尖瓣,或者二者之一(24)。
最后,在封堵器释放完成后应立即采用TEE评估人工瓣膜和结构功能。为了确认封堵器置于合适的位置而冠状动脉的血流未受影响,有必要进行冠状动脉造影。
术后随访
TTE在对人工瓣膜周漏修复术后的随访中也有重要作用。对于潜在的残余漏,必须及时发现并进行量化,从而记录其稳定性或是相反的不利预后。遗憾的是,此前讨论过的术前评估的缺陷仍将影响随访中对残余漏评估的准确性。
对于怀疑术后返流进行性加重时,需要进行其他手段(TEE、三维超声心动图或者CT)的检查。
结论
与传统的治疗方式相比,经皮介入治疗严重的症状性瓣周漏,具有创伤小、安全的优势。心脏影像技术,特别是三维超声心动图,在诊断、患者的选择及介入治疗围手术期的精确的监护中,发挥了重要的作用。
随着技术的进一步发展,介入医生经验的积累,以及影像技术的发展,都将有助于高危的患者选择这一新型的治疗方式。
Acknowledgements
声明: 作者与文中内容无利益冲突。
特别感谢译者:王凯,温州医科大学附属第一医院儿科,浙江,中国
References
- Hammermeister K, Sethi GK, Henderson WG, et al. Outcomes 15 years after valve replacement with a mechanical versus a bioprosthetic valve: final report of the Veterans Affairs randomized trial. J Am Coll Cardiol 2000;36:1152-8. [PubMed]
- Ionescu A, Fraser AG, Butchart EG. Prevalence and clinical significance of incidental paraprosthetic valvar regurgitation: a prospective study using transoesophageal echocardiography. Heart 2003;89:1316-21. [PubMed]
- Safi AM, Kwan T, Afflu E, et al. Paravalvular regurgitation: a rare complication following valve replacement surgery. Angiology 2000;51:479-87. [PubMed]
- Skoularigis J, Essop MR, Skudicky D, et al. Frequency and severity of intravascular hemolysis after left-sided cardiac valve replacement with Medtronic Hall and St. Jude Medical prostheses, and influence of prosthetic type, position, size and number. Am J Cardiol 1993;71:587-91. [PubMed]
- Kliger C, Eiros R, Isasti G, et al. Review of surgical prosthetic paravalvular leaks: diagnosis and catheter-based closure. Eur Heart J 2013;34:638-49. [PubMed]
- Jelnin V, Co J, Muneer B, et al. Three dimensional CT angiography for patients with congenital heart disease: scanning protocol for pediatric patients. Catheter Cardiovasc Interv 2006;67:120-6. [PubMed]
- García E, Sandoval J, Unzue L, et al. Paravalvular leaks: mechanisms, diagnosis and management. EuroIntervention 2012;8 Suppl Q:Q41-52.
- Pflaumer A, Schwaiger M, Hess J, et al. Quantification of periprosthetic valve leakage with multiple regurgitation jets by magnetic resonance imaging. Pediatr Cardiol 2005;26:593-4. [PubMed]
- Deftereos S, Giannopoulos G, Raisakis K, et al. Intracardiac echocardiography imaging of periprosthetic valvular regurgitation. Eur J Echocardiogr 2010;11:E20. [PubMed]
- McMurray JJ, Adamopoulos S, Anker SD, et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012;33:1787-847. [PubMed]
- Shapira Y, Bairey O, Vatury M, et al. Erythropoietin can obviate the need for repeated heart valve replacement in high-risk patients with severe mechanical hemolytic anemia: case reports and literature review. J Heart Valve Dis 2001;10:431-5. [PubMed]
- Genoni M, Franzen D, Vogt P, et al. Paravalvular leakage after mitral valve replacement: improved long-term survival with aggressive surgery? Eur J Cardiothorac Surg 2000;17:14-9. [PubMed]
- Echevarria JR, Bernal JM, Rabasa JM, et al. Reoperation for bioprosthetic valve dysfunction. A decade of clinical experience. Eur J Cardiothorac Surg 1991;5:523-6; discussion 527. [PubMed]
- Al Halees Z. An additional maneuver to repair mitral paravalvular leak. Eur J Cardiothorac Surg 2011;39:410-1. [PubMed]
- Piéchaud JF. Percutaneous closure of mitral paravalvular leak. J Interv Cardiol 2003;16:153-5. [PubMed]
- Kim MS, Casserly IP, Garcia JA, et al. Percutaneous transcatheter closure of prosthetic mitral paravalvular leaks: are we there yet? JACC Cardiovasc Interv 2009;2:81-90. [PubMed]
- Zamorano JL, Badano LP, Bruce C, et al. EAE/ASE recommendations for the use of echocardiography in new transcatheter interventions for valvular heart disease. Eur Heart J 2011;32:2189-214. [PubMed]
- Zoghbi WA, Chambers JB, Dumesnil JG, et al. Recommendations for evaluation of prosthetic valves with echocardiography and doppler ultrasound: a report From the American Society of Echocardiography's Guidelines and Standards Committee and the Task Force on Prosthetic Valves, developed in conjunction with the American College of Cardiology Cardiovascular Imaging Committee, Cardiac Imaging Committee of the American Heart Association, the European Association of Echocardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography and the Canadian Society of Echocardiography, endorsed by the American College of Cardiology Foundation, American Heart Association, European Association of Echocardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography, and Canadian Society of Echocardiography. J Am Soc Echocardiogr 2009;22:975-1014. [PubMed]
- Becerra JM, Almeria C, de Isla LP, et al. Usefulness of 3D transoesophageal echocardiography for guiding wires and closure devices in mitral perivalvular leaks. Eur J Echocardiogr 2009;10:979-81. [PubMed]
- Kumar R, Jelnin V, Kliger C, et al. Percutaneous paravalvular leak closure. Cardiol Clin 2013;31:431-40. [PubMed]
- De Cicco G, Lorusso R, Colli A, et al. Aortic valve periprosthetic leakage: anatomic observations and surgical results. Ann Thorac Surg 2005;79:1480-5. [PubMed]
- Rodríguez Muñoz D, Lázaro Rivera C, Zamorano Gómez JL. Guidance of treatment of perivalvular prosthetic leaks. Curr Cardiol Rep 2014;16:430. [PubMed]
- Lázaro Cd, Hinojar Baydes R, Zamorano JL. Colour-flow Doppler 3D TEE showing. Asvide 2014;1:262. Available online: http://www.asvide.com/articles/275
- Kliger C, Eiros R, Isasti G, et al. Review of surgical prosthetic paravalvular leaks: diagnosis and catheter-based closure. Eur Heart J 2013;34:638-49. [PubMed]